题目内容
日常所用的干电池其电极分别为碳棒(上面有铜帽)和锌(皮),以糊状NH4Cl和ZnCl2作为电解质(其中加入MnO2吸收H2),电极反应可简化为:Zn-2e-A.Zn为正极,碳为负极
B.Zn为负极,碳为正极
C.工作时电子由碳极经外电路流向锌极
D.长时间继续使用时内装的糊状物可能流出腐蚀所用的电器
BD
解析:对于原电池,相对活泼(指金属性)的一极为负极,相对不活泼的一极为正极,B项正确。在外电路中,正极的电势比负极的电势高,故电路中电流的方向是正极指向负极,所以电子应从负极流向正极,C项不正确。长时间连续使用该原电池,由于锌皮慢慢溶解而被腐蚀,且MnO2不断吸收H2生成H2O,糊状物也越来越稀,故很可能流出腐蚀电器,D项正确。

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
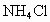 和
和 作为电解液(其中加入
作为电解液(其中加入 吸收
吸收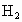 ),电极反应可简化为
),电极反应可简化为 ,
,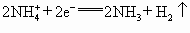 (
( 与
与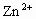 结合,)根据上述叙述判断以下正确的是
结合,)根据上述叙述判断以下正确的是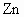 为正极,碳为负极
为正极,碳为负极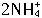 +2e-=2NH3↑+H2↑(NH3与Zn2+络合)。根据上面叙述判断下列结论正确的是( )。
+2e-=2NH3↑+H2↑(NH3与Zn2+络合)。根据上面叙述判断下列结论正确的是( )。