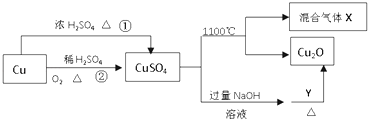
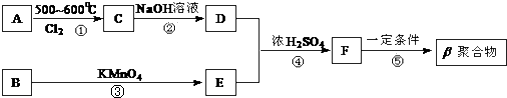
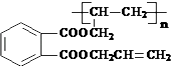��Ŀ����
����Ŀ���״���һ����Ҫ���л�����ԭ�ϣ���������Ŀǰ�ҹ��������������յĺ����Dz���һ����̼������ѹ�ϳɷ�����Ҫ��Ӧ���£�CO��g��+2H2��g���TCH3OH��g������H=��111.0kJ/mol���и���Ӧ��2CO+2H2O�TCO2+CH4 �ȣ���ѹ��������ѹ��Ϊ10��15MPa���¶ȿ�����513K��543K�����ô�����CuO��ZnO��Al2O3 �� �ϳɼ״���������ͼ��ʾ��
��ش�
��1��ʵ��������CO���ܹ��������������ʻ���ʹ����ʧȥ���ԣ�����������������ģ�ָ���������ɣ��� ��
��2����ȡ10��15MPaѹ�������������¶ȿ�����513K��543K��ԭ���� ��
��3��ԭ�����е�H2S��ͭ����Ӱ�����أ��ʱ���ȥ��֮��ͨ������ʯ�ҳ��ӣ��÷�Ӧ�Ļ�ѧ����ʽΪ��
��4���ּ״��к��ж����ѵȸ�����ڳ�ѹ������ּ״������Ȼ�õ��������д�ṹ��ʽ������õļ״��ֿ��������������ɼ�ȩ���÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��5����CO��ת����Ϊ80%������22.4M3�������CO�����H2��ַ�Ӧ��������������Ӧ�������Ƶô���Ϊ96%�ļ״�������Ϊkg��ͬʱ�������kJ��
���𰸡�
��1���ȿ��Է�ֹ����ٸ���Ӧ�������ֿɴ��߷�Ӧ�ȱ���������ȶ��ж�
��2����ѹ���������COת���ʣ���Ҳ��������Դ���ĺ��豸ǿ�ȣ����˲�ȡ����Ч��Ϻõ�ѹ�������¶��´������Խϸߣ��״����ʽϴ�
��3��H2S+CaO=CaS+H2O
��4��CH3OCH3��2CH3OH+O2 ![]() 2HCHO+2H2O
2HCHO+2H2O
��5��26.67��8.88��104
���������⣺��1�������������һ����̼��ת���ʣ���ֹ����Ӧ�����������������ֿɴ��߷�Ӧ�������ʴ�Ϊ���ȿ��Է�ֹ����ٸ���Ӧ�������ֿɴ��߷�Ӧ�ȱ���������ȶ��ж�����2��CO��g��+2H2��g���TCH3OH��g������H=��111.0kJ/mol������Ӧ�����������С�ķ�Ӧ������ѹǿ��Ȼ������ƽ�������ƶ�����״��IJ�������ѹ������豸��ǿ��Ҫ��߳ɱ������Լ�ѹ���������COת���ʣ���Ҳ��������Դ���ĺ��豸ǿ�ȣ����˲�ȡ����Ч��Ϻõ�ѹ��������Ӧ�Ƿ��ȷ�Ӧ���������ڼ״����ɵĽǶ�Ӧ�ǵ��£����¶ȹ��ʹﲻ�������Ļ��ԣ����Դ��¶��´������Խϸߣ��״����ʽϴʴ�Ϊ����ѹ���������COת���ʣ���Ҳ��������Դ���ĺ��豸ǿ�ȣ����˲�ȡ����Ч��Ϻõ�ѹ�������¶��´������Խϸߣ��״����ʽϴ�3��ԭ�����е�H2S��ͭ����Ӱ�����أ��ʱ���ȥ��֮��ͨ������ʯ�ҳ��ӣ������ƺ�ˮ�����Է�Ӧ�Ļ�ѧ����ʽΪH2S+CaO=CaS+H2O���ʴ�Ϊ��H2S+CaO=CaS+H2O����4���״����Ӽ������������Էе���ڶ����ѣ��������Ȼ�õ�����Ƕ����ѣ����Ĵ�����ʵ�������⣬���Է�Ӧ����ʽΪ��2CH3OH+O2 ![]() 2HCHO+2H2O���ʴ�Ϊ��CH3OCH3 �� 2CH3OH+O2
2HCHO+2H2O���ʴ�Ϊ��CH3OCH3 �� 2CH3OH+O2 ![]() 2HCHO+2H2O����5������ CO��g��+2H2��g���TCH3OH��g������1mol��һ����̼����32��10��3kg�ļ״���22.4M3������������ʵ���Ϊ��
2HCHO+2H2O����5������ CO��g��+2H2��g���TCH3OH��g������1mol��һ����̼����32��10��3kg�ļ״���22.4M3������������ʵ���Ϊ�� ![]() =103mol�����Կ��Ƶô���Ϊ96%�ļ״�������Ϊ
=103mol�����Կ��Ƶô���Ϊ96%�ļ״�������Ϊ ![]() =26.67kg������CO��g��+2H2��g���TCH3OH��g������H=��111.0kJ/mol��1molCO��ȫ��Ӧ�ų�111KJ��������103mol��80%=800mol�����Էų�����Ϊ��111��800=8.88��104kJ���ʴ�Ϊ��26.67kg��8.88��104kJ�� ��̬����ˮ�����Ϳ����Ʊ�������һ����̼��������̼������Ȼ�����壬ͨ��������ȥ������̼�õ�������һ����̼�����⣬Ȼ���ȥ���⣬���յõ�������̼�������Ļ�����壬��ѹ����Һ̬��һ����̼��������Ȼ���ںϳ����кϳɵõ��ֲ�Ʒ��������ü״�����1�������������һ����̼��ת���ʣ���ֹ����Ӧ�����������������ֿɴ��߷�Ӧ��������2��CO��g��+2H2��g���TCH3OH��g������H=��111.0kJ/mol������Ӧ�����������С�ķ�Ӧ������ѹǿ��Ȼ������ƽ�������ƶ�����״��IJ�������ѹ������豸��ǿ��Ҫ��߳ɱ�������Ӧ�Ƿ��ȷ�Ӧ���������ڼ״����ɵĽǶ�Ӧ�ǵ��£����¶ȹ��ʹﲻ�������Ļ��ԣ���3��ԭ�����е�H2S��ͭ����Ӱ�����أ��ʱ���ȥ��֮��ͨ������ʯ�ҳ��ӣ������ƺ�ˮ�����Է�Ӧ�Ļ�ѧ����ʽΪH2S+CaO=CaS+H2O����4���״����Ӽ������������Էе���ڶ����ѣ��������Ȼ�õ�����Ƕ����ѣ����Ĵ�����ʵ�������⣬���Է�Ӧ����ʽΪ��2CH3OH+O2
=26.67kg������CO��g��+2H2��g���TCH3OH��g������H=��111.0kJ/mol��1molCO��ȫ��Ӧ�ų�111KJ��������103mol��80%=800mol�����Էų�����Ϊ��111��800=8.88��104kJ���ʴ�Ϊ��26.67kg��8.88��104kJ�� ��̬����ˮ�����Ϳ����Ʊ�������һ����̼��������̼������Ȼ�����壬ͨ��������ȥ������̼�õ�������һ����̼�����⣬Ȼ���ȥ���⣬���յõ�������̼�������Ļ�����壬��ѹ����Һ̬��һ����̼��������Ȼ���ںϳ����кϳɵõ��ֲ�Ʒ��������ü״�����1�������������һ����̼��ת���ʣ���ֹ����Ӧ�����������������ֿɴ��߷�Ӧ��������2��CO��g��+2H2��g���TCH3OH��g������H=��111.0kJ/mol������Ӧ�����������С�ķ�Ӧ������ѹǿ��Ȼ������ƽ�������ƶ�����״��IJ�������ѹ������豸��ǿ��Ҫ��߳ɱ�������Ӧ�Ƿ��ȷ�Ӧ���������ڼ״����ɵĽǶ�Ӧ�ǵ��£����¶ȹ��ʹﲻ�������Ļ��ԣ���3��ԭ�����е�H2S��ͭ����Ӱ�����أ��ʱ���ȥ��֮��ͨ������ʯ�ҳ��ӣ������ƺ�ˮ�����Է�Ӧ�Ļ�ѧ����ʽΪH2S+CaO=CaS+H2O����4���״����Ӽ������������Էе���ڶ����ѣ��������Ȼ�õ�����Ƕ����ѣ����Ĵ�����ʵ�������⣬���Է�Ӧ����ʽΪ��2CH3OH+O2 ![]() 2HCHO+2H2O����5������ CO��g��+2H2��g���TCH3OH��g������1mol��һ����̼����32��10��3kg�ļ״���22.4M3������������ʵ���Ϊ��
2HCHO+2H2O����5������ CO��g��+2H2��g���TCH3OH��g������1mol��һ����̼����32��10��3kg�ļ״���22.4M3������������ʵ���Ϊ�� ![]() =103mol������CO��g��+2H2��g���TCH3OH��g������H=��111.0kJ/mol��1molCO��ȫ��Ӧ�ų�111KJ���������ɴ˷������
=103mol������CO��g��+2H2��g���TCH3OH��g������H=��111.0kJ/mol��1molCO��ȫ��Ӧ�ų�111KJ���������ɴ˷������

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�