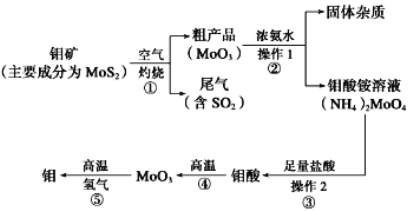
题目内容
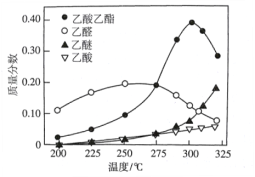
【题目】近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g),在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是
CH3COOC2H5(g)+2H2(g),在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是
A. 反应温度不宜超过300℃
B. 该反应属于消去反应
C. 在催化剂作用下,乙醛是反应历程中的中间产物
D. 提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
【答案】B
【解析】
根据图像可以看出乙酸乙酯的产量在300℃左右会最高,反应过程中有少量乙醛的生成,极少量的乙醚和乙酸等出现,适当的催化剂能加快化学反应速率,减小副产物可以提高产率,据此分析作答。
A. 通过图像分析出,当温度高于300℃时,乙酸乙酯的质量分数开始下降,所以反应温度不宜高于300℃。故A正确;
B. 根据反应2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g)及图像可看出,在催化剂的作用下,乙醇先生成乙醛,发生去氢氧化反应,进一步生成乙酸乙酯,并不是消去反应,故B项错误;
CH3COOC2H5(g)+2H2(g)及图像可看出,在催化剂的作用下,乙醇先生成乙醛,发生去氢氧化反应,进一步生成乙酸乙酯,并不是消去反应,故B项错误;
C. 因液态收集物中乙醛产量初期偏大,但是慢慢就随着乙酸乙酯的产量增大而减小,所以它应是中间产物,故C项正确;
D. 乙醇有可能会生成乙烯或乙醚等副产物,因乙烯是气体物质,所以图中没显示。催化剂有选择性,如果选择优质的催化剂可以提高反应速率,同时减小副反应过程的发生可提高产率,故D项正确;
答案选A。

【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)晶体,设计了如下流程:

已知:(1)常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Al3+ | 3.3 | 5.0 |
(2)七水合硫酸亚铁(FeSO4·7H2O)的溶解度
温度/℃ | 10 | 20 | 30 | 40 | 50 |
FeSO4·7H2O溶解度(g) | 15.5 | 26.5 | 32.9 | 40.2 | 48.9 |
(1)溶解烧渣选用足量硫酸,写出Fe2O3与硫酸反应的离子方程式_______________;检验溶液1中含有Fe3+的实验方法是___________________;
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式___________________;
(3)试剂X是__________________;固体2是___________________;
(4)加入NaOH溶液控制pH应不超过_________________;
(5)从溶液2中获得晶体的的方法为______________, _____________过滤、洗涤、干燥。