题目内容
据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
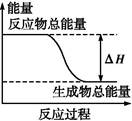
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ?△H=" -556.0" kJ·mol-1
③ H2O(g)=H2O(l)?△H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ?△H=" -556.0" kJ·mol-1
③ H2O(g)=H2O(l)?△H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
(1)c(Na+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+)
(2)CO+4OH—-2e-=CO32-+2H2O(2分)
(3)2Fe3++SO2+2H2O=SO42-+2Fe2++4H+
(4)5.6×10—5mo1/L
(5)CH3OH(l)+3/2O2(g) = CO2(g)+2H2O(l) △H=" -725.8" kJ·mol-1
(2)CO+4OH—-2e-=CO32-+2H2O(2分)
(3)2Fe3++SO2+2H2O=SO42-+2Fe2++4H+
(4)5.6×10—5mo1/L
(5)CH3OH(l)+3/2O2(g) = CO2(g)+2H2O(l) △H=" -725.8" kJ·mol-1
试题分析:(1)根据CO2和NaOH之间反应的定量关系判断。当二者按照1:1反应时,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠;0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是等浓度的碳酸钠和碳酸氢钠的混合液,在混合物液中碳酸根离子水解程度大于碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),强碱弱酸盐水解显碱性,所以c(OH-)>c(H+),盐类水解一般是微弱的,所以c(CO32-)>c(OH-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);(2)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,CO发生氧化反应,作原电池的负极,该电极生成的二氧化碳与KOH溶液反应生成碳酸钾和水,电极反应式为:CO+4OH—-2e-=CO32-+2H2O;(3)根据催化剂相关知识解答。催化剂通过参与反应改变反应历程,改变反应的活化能来改变化学反应速率,而本身的质量和化学性质不变。反应中包括催化剂参与反应的过程和催化剂的再生过程。 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,利用总反应2SO2+O2+2H2O=2H2SO4减去4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O得另一反应的离子方程式为 2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中
c(CO32-)为1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)=2.8×10-9可知,c(Ca2+)=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为5.6×10-5mol/L;(5)已知在常温常压下:①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1② 2CO(g)+O2(g)=2CO2(g) ?△H=" -556.0" kJ·mol-1③ H2O(g)=H2O(l)? △H=" -44.0" kJ·mol-1,根据盖斯定律:①+②×1/2+③×2得体现甲醇燃烧热的热化学方程式 CH3OH(l)+3/2O2(g) = CO2(g)+2H2O(l) △H=" -725.8" kJ·mol-1。

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
 HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3-+ H+ Ka1(H2CO3)=4.45×10-7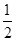 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则H2的燃烧热为-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则H2的燃烧热为-241.8 kJ·mol-1