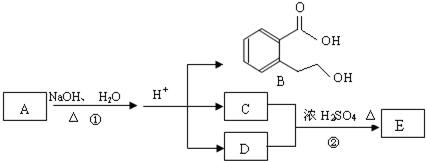
题目内容
(2012?万安县模拟)下表是元素周期表的一部分,有关说法不正确的是( )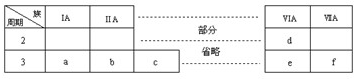

分析:由元素在周期表中的位置可知,a为Na,b为Mg,c为Al,d为O,e为S,f为Cl,
A.镁与二氧化碳能反应;
B.电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小;
C.氧化铝为两性氧化物;
D.a、c、e的最高价氧化物对应水化物分别为NaOH、Al(OH)3、H2SO4.
A.镁与二氧化碳能反应;
B.电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小;
C.氧化铝为两性氧化物;
D.a、c、e的最高价氧化物对应水化物分别为NaOH、Al(OH)3、H2SO4.
解答:解:由元素在周期表中的位置可知,a为Na,b为Mg,c为Al,d为O,e为S,f为Cl,
A.因二氧化碳属于酸性氧化物,镁与二氧化碳能反应生成氧化镁和碳,故A错误;
B.电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则a、b、d、f四种元素的离子半径:f>d>a>b,故B正确;
C.氧化铝为两性氧化物,则元素c的氧化物为氧化铝,既能与酸反应又能与碱反应,故C正确;
D.a、c、e的最高价氧化物对应水化物分别为NaOH、Al(OH)3、H2SO4,Al(OH)3为两性氢氧化物,则最高价氧化物对应水化物之间能够相互反应,故D正确;
故选A.
A.因二氧化碳属于酸性氧化物,镁与二氧化碳能反应生成氧化镁和碳,故A错误;
B.电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则a、b、d、f四种元素的离子半径:f>d>a>b,故B正确;
C.氧化铝为两性氧化物,则元素c的氧化物为氧化铝,既能与酸反应又能与碱反应,故C正确;
D.a、c、e的最高价氧化物对应水化物分别为NaOH、Al(OH)3、H2SO4,Al(OH)3为两性氢氧化物,则最高价氧化物对应水化物之间能够相互反应,故D正确;
故选A.
点评:本题考查位置、结构、性质,学生根据元素周期表得出元素,并熟悉元素及其化合物的性质是解答本题的关键,题目难度不大,选项A为解答的难点.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案
相关题目