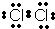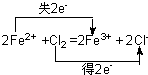题目内容
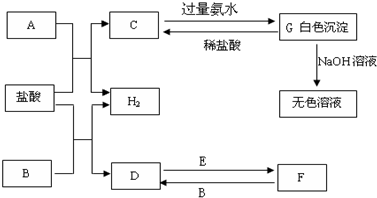
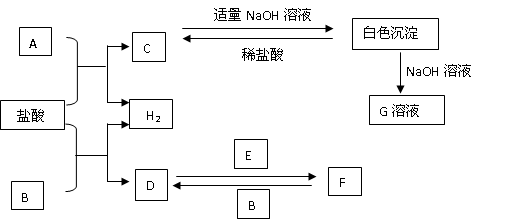
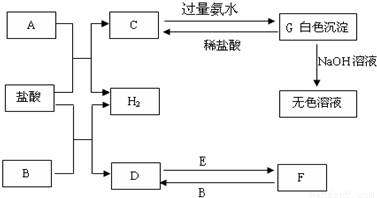
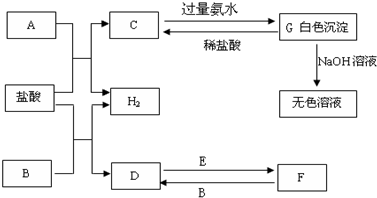
下列物质A~G是我们熟悉的单质或化合物,其中A、B均是常见的金属,E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化.
试回答下列问题:
(1)写出E的电子式______
(2)写出C→G的离子方程式______
写出沉淀G与氢氧化钠溶液反应的化学方程式______
(3)写出D→F的离子方程式并用双线桥标出电子转移方向与数目______
(4)检验F中金属阳离子的试剂(写化学式)______.
解:E在常温下是黄绿色气体,E为Cl2,A、B均是常见的金属,G为白色沉淀,能溶于强碱,则G为Al(OH)3,由元素守恒及转化可知,A为Al,C为AlCl3,又由D、F的转化可知,B为变价金属,则B为Fe,D为FeCl2,F为FeCl3,
(1)由上述分析可知,E的电子数为 ,故答案为:
,故答案为: ;
;
(2)C→G的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,沉淀G与氢氧化钠溶液反应的化学方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;Al(OH)3+OH-=AlO2-+2H2O;
(3)D→F的离子方程式并用双线桥标出电子转移方向与数目为 ,
,
故答案为: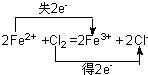 ;
;
(4)F中金属阳离子为Fe3+,遇KSCN溶液变为血红色,可利用此检验,故答案为:KSCN.
分析:E在常温下是黄绿色气体,E为Cl2,A、B均是常见的金属,G为白色沉淀,能溶于强碱,则G为Al(OH)3,由元素守恒及转化可知,A为Al,C为AlCl3,又由D、F的转化可知,B为变价金属,则B为Fe,D为FeCl2,F为FeCl3,然后结合单质、化合物的性质及化学用语来解答.
点评:本题考查无机物的推断,物质的推断是解答本题的关键,明确结合物质的性质及转化关系即可解答,注意E为氯气及B为变价金属、G的两性为解答的突破口,题目难度不大.
(1)由上述分析可知,E的电子数为
 ,故答案为:
,故答案为: ;
;(2)C→G的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,沉淀G与氢氧化钠溶液反应的化学方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;Al(OH)3+OH-=AlO2-+2H2O;
(3)D→F的离子方程式并用双线桥标出电子转移方向与数目为
 ,
,故答案为:
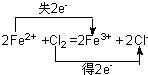 ;
; (4)F中金属阳离子为Fe3+,遇KSCN溶液变为血红色,可利用此检验,故答案为:KSCN.
分析:E在常温下是黄绿色气体,E为Cl2,A、B均是常见的金属,G为白色沉淀,能溶于强碱,则G为Al(OH)3,由元素守恒及转化可知,A为Al,C为AlCl3,又由D、F的转化可知,B为变价金属,则B为Fe,D为FeCl2,F为FeCl3,然后结合单质、化合物的性质及化学用语来解答.
点评:本题考查无机物的推断,物质的推断是解答本题的关键,明确结合物质的性质及转化关系即可解答,注意E为氯气及B为变价金属、G的两性为解答的突破口,题目难度不大.

练习册系列答案
相关题目