题目内容
下列四个反应中,酸所体现的性质与其他三者有所不同的是
- A.Cu+2H2SO4
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O - B.H2S+H2SO4→S↓+SO2↑+2H2O
- C.Ag+2HNO3→AgNO3+NO2↑+H2O
- D.3Fe3O4+28HNO3→9Fe(NO3)3+NO↑+14H2O
B
分析:A、依据元素化合价变化分析,反应中酸起到了氧化剂、酸的作用;
B、依据元素化合价变化分析,硫酸只做氧化剂;
C、依据元素化合价变化分析,硝酸只做酸;
D、依据元素化合价变化分析,反应中酸起到了氧化剂、酸的作用;
解答:A、依据元素化合价变化分析,硫酸作氧化剂被还原为二氧化硫,部分生成硫酸铜表现硫酸的酸性,所以反应中酸起到了氧化剂、酸的作用;
B、依据元素化合价变化分析,硫酸作氧化剂被还原为二氧化硫,硫酸只做氧化剂;
C、依据元素化合价变化分析,硫酸发生复分解反应,硝酸只做酸;
D、依据元素化合价变化分析,硝酸作氧化剂被还原为二氧化硫,部分生成硝酸铜表现硝酸的酸性,所以反应中酸起到了氧化剂、酸的作用;反应中酸起到了氧化剂、酸的作用;
故选B.
点评:本题考查了物质性质的分析应用,主要考查了硫酸在不同反应中的反应作用,元素化合价变化是 分析的依据,题目较简单.
分析:A、依据元素化合价变化分析,反应中酸起到了氧化剂、酸的作用;
B、依据元素化合价变化分析,硫酸只做氧化剂;
C、依据元素化合价变化分析,硝酸只做酸;
D、依据元素化合价变化分析,反应中酸起到了氧化剂、酸的作用;
解答:A、依据元素化合价变化分析,硫酸作氧化剂被还原为二氧化硫,部分生成硫酸铜表现硫酸的酸性,所以反应中酸起到了氧化剂、酸的作用;
B、依据元素化合价变化分析,硫酸作氧化剂被还原为二氧化硫,硫酸只做氧化剂;
C、依据元素化合价变化分析,硫酸发生复分解反应,硝酸只做酸;
D、依据元素化合价变化分析,硝酸作氧化剂被还原为二氧化硫,部分生成硝酸铜表现硝酸的酸性,所以反应中酸起到了氧化剂、酸的作用;反应中酸起到了氧化剂、酸的作用;
故选B.
点评:本题考查了物质性质的分析应用,主要考查了硫酸在不同反应中的反应作用,元素化合价变化是 分析的依据,题目较简单.

练习册系列答案
相关题目
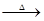 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
 S↓+SO2↑+2H2O
S↓+SO2↑+2H2O AgNO3+NO2↑+H2O
AgNO3+NO2↑+H2O