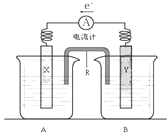
��Ŀ����
����Ŀ���ݱ��������Ħ��������MOTOROLA����˾�з���һ���ɼ״��������Լ�ǿ�����������Һ�������ֻ���أ����������������غ�﮵�ص�10����������ʹ��1���³��һ�Ρ��ٶ��ŵ�����У��״���ȫ����������CO2�������������CO32��
��1���õ�ط�Ӧ�������ӷ���ʽΪ____________________________________________��
��2���״���______��������Ӧ��������������ڷŵ��������Һ��pH��______����ͻ����������䣩������16�˼״���������ȫ����,�����ĵ��ܵ��������CuSO4��Һ����������������������������Ϊ80������������״���µ�O2________����
��3����������п�ѧ�������һ�ֹ������ʵ�ȼ�ϵ�أ���Ч�ʸ��ߡ�һ���缫ͨ���������һ�缫ͨ���������������й��������Dz�����Y2O3��Y���ƣ���ZrO2��Zr��ﯣ����壬���ڸ������ܴ���O2�����ӣ�����������Ӧ������ȫ�����Զ��飨C4H10���������͡�
�ٵ�صĸ�����ӦʽΪ____________________________________________��
�ڷŵ�ʱ�����������O2�����ӵ��ƶ���������____________���ƶ�����������
���𰸡� 2CH3OH��3O2��4OH��==2CO32��+6H2O �� ���� 13.44 C4H10��13O2����26e�� == 4CO2 ��5H2O ��
��������������������⿼��״�ȼ�ϵ�غ���ȼ�ϵ�صĹ���ԭ�����йص绯ѧ�ļ��㡣
��1���ŵ�����м״��������ɵ�CO2��ǿ��Һ�����������CO32-����ط�Ӧ�������ӷ���ʽΪ2CH3OH��3O2��4OH��=2CO32��+6H2O��
��2���״�����ʧ���ӵ�������Ӧ���״��ڸ���������Ӧ������ڷŵ����������OH-������H2O�����Էŵ��������Һ��pH�����͡��״������ĵ缫��ӦΪCH3OH-6e��+8OH��=CO32-+6H2O�����CuSO4��Һʱ����O2�ĵ缫��ӦʽΪ4OH��-4e��=O2��+2H2O�����ݵ����غ��� ![]() 6
6![]() 80%=
80%=![]() 4�����V��O2��=13.44L��
4�����V��O2��=13.44L��
��3��������ܷ�ӦΪ2C4H10+13O2=8CO2+10H2O�����ڹ��������ڸ������ܴ���O2-����ص�������ӦʽΪO2+4e��=2O2-��������Ӧʽ�ɵ���ܷ�Ӧ��ȥ������Ӧʽ����ȥO2����������ӦʽΪ2C4H10-52e��+26O2-=8CO2+10H2O����һ������ΪC4H10-26e��+13O2-=4CO2+5H2O��
��O2-Ϊ�����ӣ�Ӧ���ƶ���

 ����νӽ̲���ĩ���Ԥϰ�人������ϵ�д�
����νӽ̲���ĩ���Ԥϰ�人������ϵ�д� ������ҵ��ٳɳ����½������������ϵ�д�
������ҵ��ٳɳ����½������������ϵ�д�