题目内容
12.将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份.将其中的一份直接加热至恒重,质量减轻了1.24g;另一份加入一定;量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24L气体,消耗盐酸40.0mL.试计算:(1)原均匀混合物中NaHCO3的物质的量.n(NaHCO3)=0.08mol.
(2)盐酸的浓度c(HCl)=4mol/L.
分析 (1)固体加热时发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,利用差量法可计算原混合物中NaHCO3质量,进而计算碳酸氢钠的质量;
(2)收集到标准状况下2.24L气体,所以一份中碳酸钠和碳酸氢钠的物质的量之和为0.1mol,所以碳酸钠的物质的量为0.06mol,与一定量某浓度的盐酸至恰好反应完全,生成氯化钠,所以盐酸的物质的量为:0.04+0.06×2=0.16mol,根据c=$\frac{n}{V}$.
解答 解:(1)固体加热时发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
168g 62g
x 1.24g,
x=$\frac{168×1.24}{62}$=3.36g,n(NaHCO3)=$\frac{3.36g}{84g/mol}$=0.04mol,
原均匀混合物中NaHCO3的物质的量.n(NaHCO3)=0.08mol,故答案为:0.08mol;
(2)收集到标准状况下2.24L气体,所以一份中碳酸钠和碳酸氢钠的物质的量之和为0.1mol,所以碳酸钠的物质的量为0.06mol,与一定量某浓度的盐酸至恰好反应完全,生成氯化钠,所以盐酸的物质的量为:0.04+0.06×2=0.16mol,所以盐酸的浓度c(HCl)=4.00mol/L,故答案为:4.
点评 本题考查混合物的有关计算,清楚发生的反应时解题关键,难度中等,(1)中利用差量法计算,结合计算过程,(2)注意利用守恒思想进行计算.

 名校课堂系列答案
名校课堂系列答案| A. | 在氧化还原反应中,阴离子只能发生氧化反应 | |
| B. | 碳酸钠溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| C. | 有些吸热反应不需要加热也能进行 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| A. | H+、Ca2+、Cl-、CO32- | B. | Cl-、ClO-、K+、H+ | ||
| C. | Na+、Fe3+、SO42-、OH- | D. | Na+、Cu2+、Cl-、SO42- |
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
| A. | 将钢片插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| B. | 稀硫酸与Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加醋酸:SiO32-+2H+=H2SiO3↓ |
| A. |  鉴别碳酸钠和碳酸氢钠 | |
| B. |  钠的燃烧 | |
| C. |  直接蒸发氯化铁溶液获得氯化铁晶体 | |
| D. |  实验室制取蒸馏水 |

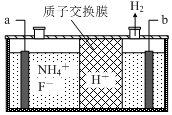 在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.
在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.
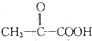 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +CO2↑
+CO2↑ $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$ +H2O
+H2O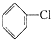 $→_{(Ⅱ)H+}^{(Ⅰ)_{10}%NaOH;Cu}$
$→_{(Ⅱ)H+}^{(Ⅰ)_{10}%NaOH;Cu}$
 +CH3COCH2COCH3$→_{△}^{NaOH(aq)}$
+CH3COCH2COCH3$→_{△}^{NaOH(aq)}$ +2H2O.
+2H2O.