题目内容
有一种白色粉末由等质量的两种物质混合而成,分别取适量该白色粉末置于三支试管中进行实验。
(1)逐滴加入6mol·L-1盐酸,同时不断振荡试管,有气泡产生,反应结束后得到无色透明溶液
(2)加热试管中的白色粉末,试管口有水滴凝结
(3)逐滴加入6mol·L-1硫酸,同时不断振荡试管,有气泡产生,反应结束后试管口还有白色难溶物
下列混合物中符合以上实验现象的是 ( )
(1)逐滴加入6mol·L-1盐酸,同时不断振荡试管,有气泡产生,反应结束后得到无色透明溶液
(2)加热试管中的白色粉末,试管口有水滴凝结
(3)逐滴加入6mol·L-1硫酸,同时不断振荡试管,有气泡产生,反应结束后试管口还有白色难溶物
下列混合物中符合以上实验现象的是 ( )
| A.NaHCO3、AgNO3 |
| B.BaCl2、MgCO3 |
| C.NH4HCO3、MgCl2 |
| D.CaCl2·6H2O、Na2CO3 |
D
正确答案:D
A、不正确,由(1)可排除无AgNO3;
B、不正确,由(2)可排除,B加热试管口无水滴凝结;
C 、不正确,由(3)可排除,逐滴加入6mol·L-1硫酸,反应结束后试管口没有白色难溶物;
D、正确。

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
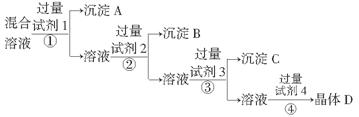
 精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
精盐的实验方案,步骤如下(用于沉淀的试剂稍过量): (5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该 Sr2+(aq)+SO2-4(aq)KSP=
Sr2+(aq)+SO2-4(aq)KSP= 2.5×10-7
2.5×10-7 论解释)
论解释) 液是实验中检验SO2-4的常用试剂。某化学研究性学习小组检验某溶液中存在SO2-4时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有SO2-4。
液是实验中检验SO2-4的常用试剂。某化学研究性学习小组检验某溶液中存在SO2-4时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有SO2-4。