题目内容
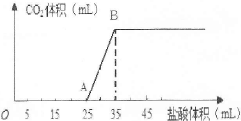
将1.66g碳酸钠和氢氧化钠的固体混合物完全溶于水,配成稀溶液,然后向该溶液中逐滴加入1mo1/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示。
提示:Na2CO3与盐酸是分步进行的,第一步为Na2CO3+HCl=NaHCO3+NaCl;第二步为NaHCO3+HCl=NaCl+H2O+CO2↑。
请回答下列问题:
(1)OA段是盐酸与Na2CO3和NaOH发生的反应,反应后溶液中的溶质有 (填化学式)。
(2)当到达B点时,产生CO2的体积为 mL(标准状况)。
(3)计算原混合物中Na2CO3的质量分数。(写出计算过程,结果保留小数点后一位)
提示:Na2CO3与盐酸是分步进行的,第一步为Na2CO3+HCl=NaHCO3+NaCl;第二步为NaHCO3+HCl=NaCl+H2O+CO2↑。

请回答下列问题:
(1)OA段是盐酸与Na2CO3和NaOH发生的反应,反应后溶液中的溶质有 (填化学式)。
(2)当到达B点时,产生CO2的体积为 mL(标准状况)。
(3)计算原混合物中Na2CO3的质量分数。(写出计算过程,结果保留小数点后一位)
(1)NaCl、NaHCO3 (共2分;答对1个给1分,答错一个不给分)
(2)224 (2分)
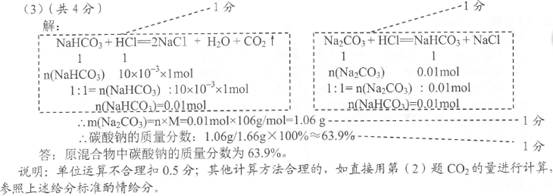
(2)224 (2分)

试题分析:(1)NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl,则OA段反应后溶液中溶质为NaCl、NaHCO3;(2)由c?V可知,AB段消耗的n(HCl)=1mol/L×(35—25)×10—3L=0.01mol;由NaHCO3+HCl=NaCl+H2O+CO2↑可知,n(CO2)=n(HCl)=0.01mol;由n?Vm可知,V(CO2)=0.224L=224mL;(3)解:
NaHCO3 + HCl=NaCl+H2O+CO2↑ Na2CO3+HCl=NaHCO3+NaCl
1 1 1 1
0.01mol 0.01mol 0.01mol 0.01mol
由n?M可知,m(Na2CO3)=1.06g
w(Na2CO3)=
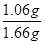 ×100%=63.9%
×100%=63.9%答:碳酸钠的质量分数为63.9%。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目