题目内容
物质的量为0.20mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )
| A、6.4g | B、8.0g |
| C、8.4g | D、9.2g |
考点:镁的化学性质
专题:计算题
分析:镁条与CO2和O2都能够发生反应,反应后固体可能为氧化镁、碳、镁的混合物,采用极限法,若镁全部与二氧化碳反应生成固体量最大,镁没有反应,则固体量最少,计算出固体的范围,然后解答.
解答:
解:镁条与二氧化碳和氧气反应的化学方程式分别为:2Mg+CO2
2MgO+C,2Mg+O2
2MgO,通过反应方程式可知当镁全部与二氧化碳反应生成固体量最大,镁没有反应,则固体量最少,则:
2Mg+CO2
2MgO+C
2 80g 12g
0.20mol 8.0g 1.2g
所以当镁全部与二氧化碳反应生成固体质量最大为 8.0g+1.2g=9.2g,当镁没有反应,则固体量最少为0g,所以固体质量取值范围为(0,9.2g),
混合气体中含有氧气,镁也会与氧气发生反应,所以固体质量应小于9.2g,
故选:D.
| ||
| ||
2Mg+CO2
| ||
2 80g 12g
0.20mol 8.0g 1.2g
所以当镁全部与二氧化碳反应生成固体质量最大为 8.0g+1.2g=9.2g,当镁没有反应,则固体量最少为0g,所以固体质量取值范围为(0,9.2g),
混合气体中含有氧气,镁也会与氧气发生反应,所以固体质量应小于9.2g,
故选:D.
点评:本题考查镁的性质及有关计算,明确镁可在二氧化碳中燃烧的特性,并用极限法来进行计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某有机物的结构为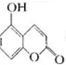 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A、1mol该物质与足量浓溴水反应,最多消耗2mol Br2 |
| B、1mol该物质最多能与2mol NaOH反应 |
| C、1mol该物质最多能与3mol H2加成 |
| D、该物质的核磁共振氢谱共有6个吸收峰 |
分离苯和水混合物的操作方法是( )
| A、过滤 | B、分液 | C、萃取 | D、蒸馏 |
金刚石与石墨是碳的两种同素异形体,在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热量,下列说法正确的是( )
| A、金刚石比石墨稳定 |
| B、1mol石墨比1mol金刚石的总能量低 |
| C、1mol石墨比1mol金刚石的总能量高 |
| D、石墨比金刚石稳定 |
已知2SO2+O2?2SO3为放热反应,关于该反应的下列说法正确的是( )
| A、O2的能量一定高于SO2的能量 |
| B、因该反应为放热反应,故不必加热反应就可发生 |
| C、SO2的能量一定高于SO3的能量 |
| D、SO2和O2的总能量一定高于SO3的总能量 |
下列实验操作正确的是( )
| A、给容量瓶检漏时,向容量瓶中注入适量水,左手托住瓶底右食指顶住瓶塞,倒置数次,观察是否漏水 |
| B、具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 |
| C、配制一定物质的量浓度的溶液时,蒸馏水洗净后容量瓶未干燥,不影响测定结果 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
 2014年3月9日凌晨,一辆拖挂车装载150桶约30吨白磷驶往山东,在雅西高速西昌收费站附近发生侧翻,车上白磷泄漏燃烧,大量白色烟雾飘进西昌城区.
2014年3月9日凌晨,一辆拖挂车装载150桶约30吨白磷驶往山东,在雅西高速西昌收费站附近发生侧翻,车上白磷泄漏燃烧,大量白色烟雾飘进西昌城区.