题目内容
下列各组物质的性质比较中,不正确的是
| A.酸性强弱:H3PO4<H2SO4<HClO4 |
| B.离子半径大小:F->Na+>Mg2+>Al3+ |
| C.稳定性大小:SiH4<PH3<H2S<HCl |
| D.沸点:新戊烷>异戊烷>正戊烷>丙烷 |
D
解析试题分析:选项A中,溶液酸性的比较,主要比较离子半径,离子半径越小酸性越强,而P、S、Cl属于同一周期。电子层数相同,电子层数相同时,原子序数越大,半径就越小。故半径从小到大的顺序应为氯、硫、磷。所以A选项是正确的.而B选项离子半径的比较,方法,先比较电子层数,层数越多半径就越大,层数相同时,原子序数越大半径越小。C选项稳定性的比较,也是比较离子半径的大小。半径越小,稳定性越强。硅、磷、硫、氯、属于同一周期,所以半径由小到大,所以C选项是正确的。
规律总结:半径越小。对应的酸性、氧化性、稳定性、非金属性也就越强。半径越大,对于的碱性、还原性、金属性就越强。D选项有机物沸点的比较的相关规律:含碳原子数越多沸点越高,碳原子数相同时,支链越多,沸点越低。故D选项是错误的。
考点:考查有机物沸点比较的相关知识

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案有机化合物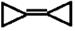 的二氯代物有
的二氯代物有
| A.2种 | B.3种 | C.4种 | D.5种 |
除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 ( )
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na ⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置: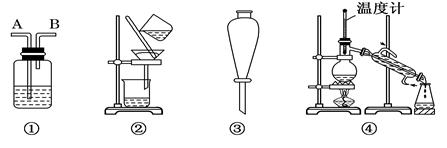
| 选项 | 物质 | 试剂 | 装置 |
| A | C2H6(C2H4) | ⑥ | ① |
| B | 苯(苯酚) | ① | ③ |
| C | CH3COOC2H5(CH3COOH) | ③ | ② |
| D | 甲苯(二甲苯) | ① | ③ |
下列各对物质中,互为同系物的是
| A.CH4、C2H4 | B.CH4、C2H5OH |
| C.C2H6、C3H8 | D.CH3COOH、C3H6 |
下列有关说法错误的是
| A.顺-2-丁烯和反-2-丁烯分别与H2加成,生成相同的加成产物 |
| B.等质量的乙烷、乙烯、乙炔完全燃烧耗氧量依次减小 |
| C.乙烷的四氯代物有2种 |
| D.(CH3)3CCl和(CH3)2CHCH2Cl分别与NaOH的乙醇溶液共热,生成不同的消去产物 |
双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。下列有关双酚A的叙述不正确的是( )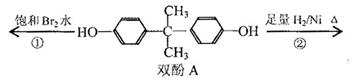
| A.双酚A的分子式是C15H16O2 |
| B.双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 |
| C.反应①中,1mol双酚A最多消耗2 mol Br2 |
| D.反应②的产物中只有一种官能团 |
某有机物的结构简式如图所示,下列说法不正确的是( )
| A.分子式为C10H12O3 |
| B.含有3种官能团 |
| C.1 mol该分子中含有3 mol双键 |
| D.既可以发生取代反应又可以发生加成反应 |
近年来媒体多次报道了数起因食用有“瘦肉精”的猪肉和内脏,而发生急性中毒的恶性事件。这足以说明,目前由于奸商的违法经营,已使“瘦肉精”变成了“害人精”。“瘦肉精”的结构可表示为: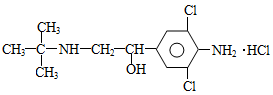
下列关于“瘦肉精”的说法中正确的是
| A.属于芳香烃 | B.分子式为C12H19Cl3N2O |
| C.摩尔质量为313.5 g | D.不能发生消去反应 |
有机物M的结构简式如图所示。下列说法中正确的是( )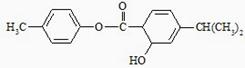
| A.M中不含手性碳原子 |
| B.M中所有碳原子均可能在同一平面 |
| C.M可以发生加成、取代、消去等反应 |
| D.1mol M常温下最多可以与3 mol NaOH反应 |