题目内容
从矿物学资料查得,一定条件下自然界存在如下反应: 14CuSO4+5 FeS2+12 H2O =7Cu2S+5 FeSO4+12 H2SO4,下列说法正确的是
A.Cu2S既是氧化产物又是还原产物
B.5molFeS2发生反应,有10mol电子转移
C.产物中的SO42-离子有一部分是氧化产物
D.FeS2只作还原剂
A、C
解析:
本题是一道相对难度比较大的氧化还原反应的应用问题,既涉及到 氧化剂和还原剂的判断、氧化还原反应方程式的配平还涉及到氧化 还原反应中的计算等。解决本题的关键是首先要读懂题意,逐步推 敲。先分析参加反应的各元素的价态变化:铜价态降低被还原,硫酸铜是氧化剂,FeS2中硫的价态为-1价,Cu2S中硫的化合价为-2价,FeSO4和H2SO4中硫的化合价为+6价,故FeS2既是氧化剂又是还原剂。产物中的SO42-一部分来源于FeS2,这部分SO42-属于氧化产物;从方程式中可以看出,5 mol FeS2参加反应时,有21 mol 电子转移。

练习册系列答案
相关题目
从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4
则关于该反应的说法正确的是( )
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4
则关于该反应的说法正确的是( )
| A、Cu2S既是氧化产物又是还原产物 | ||
| B、5mol FeS2发生反应,有10mol电子转移 | ||
| C、FeS2只作还原剂 | ||
D、产物中的SO
|
 。下列说法正确的是
。下列说法正确的是 既是氧化产物又是还原产物
既是氧化产物又是还原产物 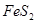 发生反应,有10 mol电子转移
发生反应,有10 mol电子转移 有一部分是氧化产物
有一部分是氧化产物