题目内容
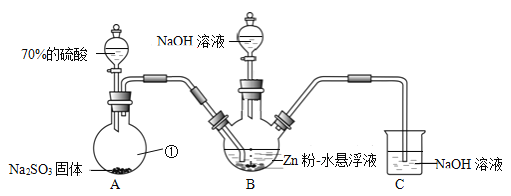
【题目】已知常温下,氨水中NH3·H2O的电离平衡常数:Kb≈1×10-5。向1 L 0.1 mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3·H2O的变化趋势如下图所示(溶液体积和温度的变化、氨的挥发均忽略不计),下列说法正确的是
与NH3·H2O的变化趋势如下图所示(溶液体积和温度的变化、氨的挥发均忽略不计),下列说法正确的是
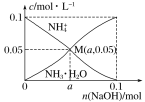
A. NH4Cl的电离方程式为:NH4Cl![]() Cl-+NH4+
Cl-+NH4+
B. M点时,pH≈9
C. a=0.05
D. 当n(NaOH)=0.05 mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
【答案】B
【解析】
M点时,c(NH4+)=c(NH3·H2O),溶液中Kb = c(OH-) ≈1×10-5 mol·L-1;若a=0.05 mol,氯化铵溶液与氢氧化钠溶液反应生成等浓度的氯化铵、一水合氨和氯化钠混合溶液,由于一水合氨的电离大于氯化铵水解,溶液中c(NH4+)> c(NH3·H2O)。
A项、NH4Cl为强电解质,在溶液中完全电离,电离方程式为:NH4Cl=Cl-+NH4+,故A错误;
B项、氨水中NH3·H2O的电离平衡常数Kb = c(NH4+) c(OH-)/ c(NH3·H2O),由图可知M点时,c(NH4+)=c(NH3·H2O),则Kb = c(OH-) ≈1×10-5 mol·L-1,溶液pH≈9,故B正确;
C项、若a=0.05 mol,氯化铵溶液与氢氧化钠溶液反应生成等浓度的氯化铵、一水合氨和氯化钠混合溶液,由于一水合氨的电离大于氯化铵水解,溶液中c(NH4+)> c(NH3·H2O),与M点时c(NH4+)=c(NH3·H2O)矛盾,故C错误;
D项、当n(NaOH)=0.05 mol时,氯化铵溶液与氢氧化钠溶液反应生成等浓度的氯化铵、一水合氨和氯化钠混合溶液,由于一水合氨的电离大于氯化铵水解,溶液中c(Cl-)> c(NH4+) > c(Na+) >c(OH-)>c(H+),故D错误。
故选B。

【题目】某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案并验证产物、探究反应原理。
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:可能是____________________。
猜测2:可能是MgCO3。
猜测3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
实验序号 | 实验 | 预期现象和结论 |
实验Ⅱ | 将实验Ⅰ中收集的气体点燃 | ______________________________________ |
实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量________ | 如果出现______________,则白色不溶物可能是MgCO3 |
实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 如果产生白色沉淀,则溶液中存在______离子 |
(3)设计定量实验确定实验Ⅰ的产物:称取实验Ⅰ中所得干燥、纯净的白色不溶物31.0 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8 g,装置B增重13.2 g,试确定白色不溶物的化学式________________________。
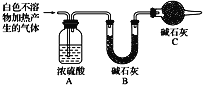
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡的原因__________。