题目内容
【题目】A、B、C、D四种元素的原子序数都小于20,A与B同主族,B与C同周期,0.2mol的C单质与足量稀H2SO4反应时放出H26.72L(标准状况),A原子最外层上的电子数比次外层上的电子数多4个,C与D的原子序数之和为24.
(1)A、B、C、D的元素名称分别为:、、、 .
(2)A的离子结构示意图为 , C的原子结构示意图为 .
(3)B原子的电子式为 , A与D的化合物的电子式为 .
(4)C的最高价氧化物对应水化物跟盐酸反应的离子方程式;跟烧碱溶液反应的离子方程式是 .
【答案】
(1)氧;硫;铝;钠
(2)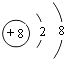 ;
;![]()
(3)![]() ;
;![]() 、
、 ![]()
(4)Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH﹣═AlO2﹣+2H2O
【解析】解:A、B、C、D四种元素的原子序数都小于20,A原子最外层上的电子数比次外层上的电子数多4个,最外层电子数不超过8,故原子只能有2个电子层,最外层电子数为6,则A为O元素;A与B同主族,则B为S元素;B与C同周期,即处于第三周期,0.2mol的C单质与足量稀H2SO4反应时放出H26.72L(标准状况),C为金属,生成氢气为 ![]() =0.3mol,根据电子转移守恒可知C的化合价为
=0.3mol,根据电子转移守恒可知C的化合价为 ![]() =+3,故C为Al,C与D的原子序数之和为24,则D为Na.
=+3,故C为Al,C与D的原子序数之和为24,则D为Na.
(1.)由上述分析可知,A为氧,B为硫,C为铝,D为钠,所以答案是:氧;硫;铝;钠;
(2.)A为O元素,O2﹣离子结构示意图为: 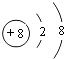 ,C为Al,原子结构示意图为:
,C为Al,原子结构示意图为: ![]() ,所以答案是:
,所以答案是: 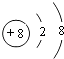 ;
; ![]() ;
;
(3.)B为S元素,原子的电子式为 ![]() ,A与D的化合物为Na2O、Na2O2 , 电子式分别为
,A与D的化合物为Na2O、Na2O2 , 电子式分别为 ![]() 、
、 ![]() ,所以答案是:
,所以答案是: ![]() ;
; ![]() 、
、 ![]() ;
;
(4.)C的最高价氧化物对应水化物为Al(OH)3 , 跟盐酸反应的离子方程式是:Al(OH)3+3H+=Al3++3H2O,跟烧碱溶液反应的离子方程式是:Al(OH)3+OH﹣═AlO2﹣+2H2O,
所以答案是:Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH﹣═AlO2﹣+2H2O.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案