题目内容
(2010?潮州二模)重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等,以铬铁矿(主要成分为Cr2O3,还有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下:
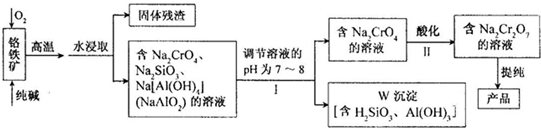
请回答下列问题.
(1)铬铁矿中的Cr2O3与纯碱、O2在高温下反应的化学方程式为
(2)若Ⅰ中只用一种试剂调节溶液的pH,应选用
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
(3)Ⅰ中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是:
3中,Na2CrO4转化为Na2Cr2O7的离子反应如下:
2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O
①该反应
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液
A.变黄色B.颜色不变C.橙红色变深
③已知:25℃,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7.25℃,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是

请回答下列问题.
(1)铬铁矿中的Cr2O3与纯碱、O2在高温下反应的化学方程式为
2Cr2O3+4Na2CO3+3O2
4Na2CrO4+4 CO2
| ||
2Cr2O3+4Na2CO3+3O2
4Na2CrO4+4 CO2
.
| ||
(2)若Ⅰ中只用一种试剂调节溶液的pH,应选用
A
A
(填标号).A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
(3)Ⅰ中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是:
Al(OH)3+3H+═Al3++3H2O
Al(OH)3+3H+═Al3++3H2O
.(用离子方程式表示).3中,Na2CrO4转化为Na2Cr2O7的离子反应如下:
2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O
①该反应
不是
不是
(填“是”或“不是”)氧化还原反应.②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液
A
A
(填标号).A.变黄色B.颜色不变C.橙红色变深
③已知:25℃,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7.25℃,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是
Ag2CrO4
Ag2CrO4
.分析:(1)Cr2O3与纯碱、O2在高温下反应生成了Na2CrO4和二氧化碳;
(2)I中要调节溶液的pH值,是要降低溶液的pH值,所以应选用酸性试剂
(3)溶液的pH过小,是H+过量了,Al(OH)3会溶解;
(4))①Ⅱ中离子方程式无元素化合价的变化,所以不是氧化还原反应;
②加入足量NaOH固体,平衡逆向移动,颜色有橙红色变成黄色,选A
③由题可知先生成Ag2Cr2O7沉淀,由Ksp知Ag2CrO4更难溶,Na2Cr2O7溶液显碱性,在碱性条件下Ag2Cr2O7最终转化成更难溶的Ag2CrO4.
(2)I中要调节溶液的pH值,是要降低溶液的pH值,所以应选用酸性试剂
(3)溶液的pH过小,是H+过量了,Al(OH)3会溶解;
(4))①Ⅱ中离子方程式无元素化合价的变化,所以不是氧化还原反应;
②加入足量NaOH固体,平衡逆向移动,颜色有橙红色变成黄色,选A
③由题可知先生成Ag2Cr2O7沉淀,由Ksp知Ag2CrO4更难溶,Na2Cr2O7溶液显碱性,在碱性条件下Ag2Cr2O7最终转化成更难溶的Ag2CrO4.
解答:解:(1)铬铁矿中的Cr2O3与纯碱、O2在高温下反应生成Na2CrO4和二氧化碳,反应的化学方程式为2Cr2O3+4Na2CO3+3O2
4Na2CrO4+4CO2,
故答案为:2Cr2O3+4Na2CO3+3O2
4Na2CrO4+4CO2;
(2)由于I中要调节溶液的pH值,是要降低溶液的pH值,所以应选用酸性试剂,故选A;
(3)如果溶液的pH过小,是H+过量了,Al(OH)3会溶解,离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+═Al3++3H2O;
①Ⅱ中离子方程式无元素化合价的变化,所以不是氧化还原反应,故答案为:不是;
②加入足量NaOH固体,平衡逆向移动,颜色有橙红色变成黄色,所以A正确,故选A;
③由题中信息可知先生成Ag2Cr2O7沉淀,由Ksp知Ag2CrO4更难溶,Na2Cr2O7溶液显碱性,在碱性条件下Ag2Cr2O7最终转化成更难溶的Ag2CrO4,
故答案为:Ag2CrO4.
| ||
故答案为:2Cr2O3+4Na2CO3+3O2
| ||
(2)由于I中要调节溶液的pH值,是要降低溶液的pH值,所以应选用酸性试剂,故选A;
(3)如果溶液的pH过小,是H+过量了,Al(OH)3会溶解,离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+═Al3++3H2O;
①Ⅱ中离子方程式无元素化合价的变化,所以不是氧化还原反应,故答案为:不是;
②加入足量NaOH固体,平衡逆向移动,颜色有橙红色变成黄色,所以A正确,故选A;
③由题中信息可知先生成Ag2Cr2O7沉淀,由Ksp知Ag2CrO4更难溶,Na2Cr2O7溶液显碱性,在碱性条件下Ag2Cr2O7最终转化成更难溶的Ag2CrO4,
故答案为:Ag2CrO4.
点评:本题考查学生对工艺流程的理解、阅读题目获取信息能力、物质推断、化学用语、化学计算、氧化还原反应等,综合性较大,难度中等,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.

练习册系列答案
相关题目