题目内容
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极)。下列说法中正确的是( )


| A.电池工作时,正极反应式为:O2+2H2O+4e- ="==" 4OH- |
| B.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| C.电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者 |
| D.当电池中消耗0.02gH2时,a极周围会产生0.02gH2 |
C
左侧是原电池,右侧是电解池。在原电池电解质是酸性溶液,所以正极反应式为O2+4H++4e- ="==" 2H2O。电子只能通过导线传递,而不能通过溶液传递。a极是阳极,OH-放电生成氧气,所以正确的答案是C。

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目




 Fe(OH)2+Ni(OH)2。下列有关该蓄电池的说法错误的是( )
Fe(OH)2+Ni(OH)2。下列有关该蓄电池的说法错误的是( )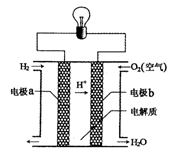
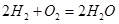
 不能自发进行,则该反应的
不能自发进行,则该反应的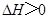
 Cd+2NiO(OH)+2H2O 则,该电池放电时的负极材料是( )。
Cd+2NiO(OH)+2H2O 则,该电池放电时的负极材料是( )。 作原理如右图所示。
作原理如右图所示。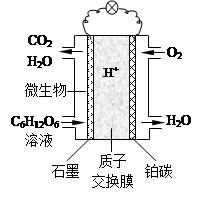
 已知石墨电极上反应为:
已知石墨电极上反应为: