题目内容
右图是硫酸试剂标签上的部分内容.下列说法正确的是( )
A.该硫酸的物质的量浓度为9.2mol/L
B.1mol锌与足量的该硫酸反应产生2g氢气
C.准确配制450mL4.6mol/L的稀硫酸需取该硫酸125mL
D.该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
【答案】分析:A、根据c=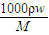 计算溶液的浓度;
计算溶液的浓度;
B、根据以上计算公式计算该硫酸溶液为浓硫酸,与锌反应生成二氧化硫气体;
C、根据溶液稀释前后溶质的物质的量不变计算;
D、该硫酸与水的密度不同,混合所得溶液的总体积不等于硫酸体积的二倍.
解答:解:A、c=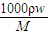 =
=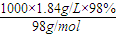 =18.4mol/L,故A错误;
=18.4mol/L,故A错误;
B、该溶液为浓硫酸,与锌反应生成二氧化硫气体,没有氢气生成,故B错误;
C、设准确配制450mL4.6mol/L的稀硫酸需取该硫酸的体积为V,应需要500ml容量瓶,
溶液稀释前后溶质的物质的量不变,
则有:0.5L×4.6mol/L=V×18.4mol/L,V= =0.125L,即125ml,故C正确;
=0.125L,即125ml,故C正确;
D、硫酸与水的密度不同,设硫酸和水的体积都为1L,混合后的密度为ρ,
则有混合后的硫酸的物质的量浓度为c=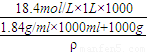 =0.64ρ
=0.64ρ
因ρ≠ g/ml,所以c≠9.2mol/L,故D错误.
g/ml,所以c≠9.2mol/L,故D错误.
故选C.
点评:本题考查物质的量浓度的计算,题目难度中等,注意硫酸溶液的密度与浓度的关系的理解也和运用.
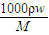 计算溶液的浓度;
计算溶液的浓度;B、根据以上计算公式计算该硫酸溶液为浓硫酸,与锌反应生成二氧化硫气体;
C、根据溶液稀释前后溶质的物质的量不变计算;
D、该硫酸与水的密度不同,混合所得溶液的总体积不等于硫酸体积的二倍.
解答:解:A、c=
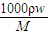 =
=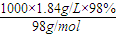 =18.4mol/L,故A错误;
=18.4mol/L,故A错误;B、该溶液为浓硫酸,与锌反应生成二氧化硫气体,没有氢气生成,故B错误;
C、设准确配制450mL4.6mol/L的稀硫酸需取该硫酸的体积为V,应需要500ml容量瓶,
溶液稀释前后溶质的物质的量不变,
则有:0.5L×4.6mol/L=V×18.4mol/L,V=
 =0.125L,即125ml,故C正确;
=0.125L,即125ml,故C正确;D、硫酸与水的密度不同,设硫酸和水的体积都为1L,混合后的密度为ρ,
则有混合后的硫酸的物质的量浓度为c=
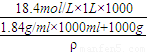 =0.64ρ
=0.64ρ因ρ≠
 g/ml,所以c≠9.2mol/L,故D错误.
g/ml,所以c≠9.2mol/L,故D错误.故选C.
点评:本题考查物质的量浓度的计算,题目难度中等,注意硫酸溶液的密度与浓度的关系的理解也和运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 右图是硫酸试剂标签上的部分内容.下列说法正确的是( )
右图是硫酸试剂标签上的部分内容.下列说法正确的是( ) 右图是硫酸试剂标签上的部分内容.下列说法正确的是
右图是硫酸试剂标签上的部分内容.下列说法正确的是
 右图是硫酸试剂标签上的部分内容。下列说法正确的是 ( )
右图是硫酸试剂标签上的部分内容。下列说法正确的是 ( )