题目内容
如下图所示的物质的相互转变中,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应。常温下,D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%。
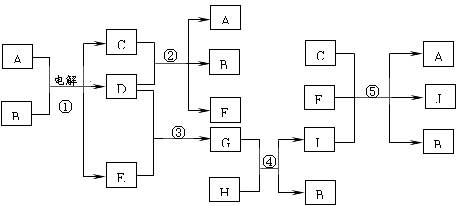
请回答下列问题:
(1)写出F的化学式: ;
(2)写出G的电子式: ;
(3)反应①的化学方程式为 ;
人们将反应①所涉及的化学工业称为 ;
(4)反应⑤的离子方程式为 ;
高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为
①Na2FeO4具有强氧化性可杀菌消毒
② 。
(1)NaClO
(2)![]()
(3)2NaCl + 2H2O = H2↑ + Cl2↑+ 2NaOH 氯碱工业
(4)2Fe3+ + 3ClO + 10OH = 2FeO42 + 3Cl + 5H2O
②本身被还原成Fe3+而发生水解生成Fe(OH)3胶体吸附水中杂质以达到净化水的目的。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案(10分)短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
|
|
Q |
R |
|
|
T |
|
|
W |
(1)T的原子结构示意图为_______________________。
(2)元素的非金属性为(原子的得电子能力):Q__________R(填“强于”或“弱于”)。(3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____________________________________。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________________________________。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是_______________。
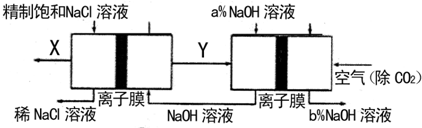
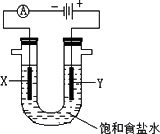
 等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是_________(填序号);
等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是_________(填序号);

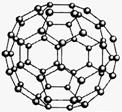 C60(结构模型如下图所示)的发现是化学界的大事之一。C60与金属钾化合生成K3C60。K3C60具有超导性。k.s.5.u
C60(结构模型如下图所示)的发现是化学界的大事之一。C60与金属钾化合生成K3C60。K3C60具有超导性。k.s.5.u