��Ŀ����
(��С��15��)�������п�ͼ��ϵ��գ���֪��Ӧ�١����ǹ�ҵ�����е���Ҫ��Ӧ��D��E������Ϊ���塢X������Ϊ��ɫҺ�壬H��E��Է�������֮��Ĺ�ϵΪ��Mr(H) ��Mr(E) =34����֪C��ɫ��Ӧ����ʻ�ɫ��
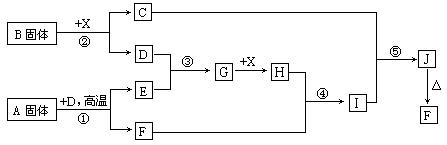
(1) ��Ӧ�ڵĻ�ѧ����ʽ��__________________________________��
����C�ĵ���ʽ��_______________________��
(1)������A���������Ļ�ѧ���У�_______________________��
(2)��Ӧ�ܵ����ӷ���ʽ��_______________________________��
��Ӧ�ݵĻ�ѧ����ʽ��__________________________________��
(3)��֪ÿ����16g E���ų�106.5 kJ��������Ӧ�ٵ��Ȼ�ѧ����ʽΪ��
_________________________________________________________ ��
��(1) 2Na2O2+2H2O===4NaOH+O2����2�֣�![]() ��2�֣�
��2�֣�
(1)���Ӽ����Ǽ��Լ� ��3�֣����1��ֻ��1�֣�
(2)Fe2O3 + 6H+ = 2Fe3+ + 3H2O��2�֣�
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3��+3Na2SO4��2�֣�
����(3)FeS2(s) + 11/4 O2(g) = 1/2 Fe2O3(s)+ 2SO2(g)����H=��852kJ/mol��4�֣�
����:
ץס��Ӧ�١����ǹ�ҵ�����е���Ҫ��Ӧ���ͻ�ƿڣ��ٽ��A�ǹ��壬�ó�����Ӧ��������FeS2��SO2��X����ɫҺ�壬ӦΪˮ��������SO3�����ǹ���B��ˮ���ò���O2�������BΪ�������ƣ������ͺý��ˡ����ܿռ䣺��������ͻ�ƿ�������Ҫ��ҵ������Ӧ������ѧ��Ҫ��ҵ������Ӧ�У�1������ʯ��ʯ 2�����ջ����� 3����������Ĵ����� 4�����Ĵ����� 5���ϳɰ� ��6����ⱥ��ʳ��ˮ 7����ҵ������ 8����¯���� 9����ҵ��ȡƯ�۾� 10����ҵ��ˮú�� 11�������ι�ҵ�ȡ�
Ӧ�Բ��ԣ���һ���ͼ�ƶ��⣬������ѧ��ѧ�Ĺ�ҵ����ԭ���������Ԫ�ػ������֪ʶ���ۺϿ��鹤ҵ�����г�������������ʣ���һ�����ۺ��ԡ���Ŀ��һ���Ѷȣ�������ʵ�Ļ������⣬��Ҫ��һ���������֪ʶ����������ǿ������������

 ֥�鿪���γ�������ϵ�д�
֥�鿪���γ�������ϵ�д� ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�