��Ŀ����
����Ŀ��2015��˹̹����ѧ�о���Ա���Ƴ�һ�ֿ���һ��������ɳ�ŵ�ij������������ӵ�����ڲ���AlCl4�C���л������ӹ��ɵ������Һ����ŵ繤��ԭ������ͼ��ʾ������˵������ȷ����
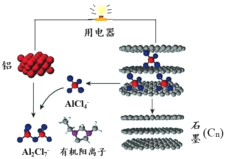
A���ŵ�ʱ����Ϊ������ʯīΪ����
B���ŵ�ʱ���л������������缫�����ƶ�
C���ŵ�ʱ�ĸ�����ӦΪ��Al �C3e- + 7AlCl4�C = 4Al2Cl7�C
D�����ʱ��������ӦΪ��Cn + AlCl4�C�Ce- = CnAlCl4
���𰸡�B
��������
���������A���ŵ�ʱ��ԭ��أ����ǻ��Ե缫��ʯīΪ���Ե缫����Ϊ������ʯīΪ��������A��ȷ��B���ŵ�ʱ��ԭ��أ���ԭ����У��������������ƶ����л������������缫��ʯī�缫�����ƶ�����B����C������ʾ��ͼ���ŵ�ʱ����Ϊ����������AlCl4�C �õ���������Al2Cl7�C��������ӦΪ��Al �C3e- + 7AlCl4�C =4Al2Cl7�C����C��ȷ��D�����ʱ����������������Ӧ���缫��ӦʽΪCn + AlCl4�C �C e- =CnAlCl4����D��ȷ����ѡB��

 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�����Ŀ��п�������ǻ��ý��������ǵĵ��ʼ�����������ʾ���һ���������ԡ�
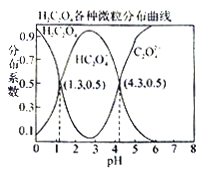
��1����ͼ��ʾ�����¶���п��ˮ��Һ�еĴ�����ʽ��pH�Ĺ�ϵ��������Ϊ��Һ��pHֵ��������ΪZn2+���ӻ�[Zn(OH)4]2-�������ʵ���Ũ�ȵĶ������ش��������⣺

��������Zn��������������������Һ�У���Ӧ�����ӷ���ʽ�ɱ�ʾΪ��
___________________________________________________________________________
����ͼ�����ݼ���ɵ�Zn(OH)2���ܶȻ�(Ksp)= _________________________��
����1L1.00 mol��L-1ZnCl2��Һ�м���NaOH������pH=6����NaOH ____ mol��
����֪����ZnCl2��Һ�м�������Ǧ�����Ǧ��Һ�����Ƶ�PbCl2��ɫ���壻25��ʱ��PbCl2�����������е��ܽ�����£�
c(HCl)/( mol��L��1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
c(PbCl2)/( mol��L��1)��10��3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
�����ϱ������ж�����˵����ȷ����____________��
A����������Ũ�ȵ�����PbCl2������ܽ�ȱ�С
B��PbCl2������0.50 mol��L-1�����е�KspС���ڴ�ˮ�е�Ksp
C��PbCl2����Ũ���ᷴӦ����һ���ѵ���������ӣ�������ӣ�
D��PbCl2��������ڱ���ʳ��ˮ
��2��������п�����������������ִ���һ���IJ��죬���������������ڰ�ˮ����������п�����ڰ�ˮ���������������[Zn(NH3)4]2+��
����25���£���a molL��1��NH4Cl��Һ��0.01molL��1��NaOH��Һ�������ϣ���Ӧ������ҺpH=7���ú�a�Ĵ���ʽ��ʾNH4+��ˮ�ⳣ��Kh=___________mol L��1��
����25��ʱ��Ũ�Ⱦ�Ϊ0.1molL��1��NH4Cl��NH3��H2O��Һ�������Ϻ���Һ�ʼ��ԣ�����ڸ���Һ��˵������ȷ����____________������ĸ����
a������Һһ����c(NH4+)+ c ( H+) = c(OH��) +c ( Cl��)
b������Һһ����c(Cl-) = c (NH3��H2O) +c��NH4+��
c�������Һ��ˮ�ĵ���̶�һ�����ڸ��¶��´�ˮ�ĵ���̶�
d������Һ���������������ƻ����ᣬ��Һ��pH�仯����