题目内容
用20gNaOH配成250mL溶液,它的物质的量浓度为 mol/L.取出5mL该溶液,它的物质的量浓度为 mol/L,再加水稀释至100mL,该100mL溶液可以跟H+浓度为0.1mol/L的硫酸溶液 mL完全中和生成正盐.
【答案】分析:根据n=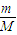 计算物质的量,根据c=
计算物质的量,根据c=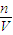 计算物质的量浓度,根据反应H++OH-=H2O计算硫酸的体积,
计算物质的量浓度,根据反应H++OH-=H2O计算硫酸的体积,
解答:解:n(NaOH)=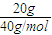 =0.5mol,
=0.5mol,
c(NaOH)=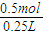 =2mol/L,
=2mol/L,
取出5mL该溶液,它的物质的量浓度不变,仍为2mol/L,其中含n(OH-)=0.005L×2mol/L=0.01mol,
根据反应H++OH-=H2O可知:
n(H+)=n(OH-)=0.01mol,
所以H+浓度为0.1mol/L的硫酸溶液的体积为:V=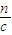 =
=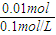 =0.1L,即100ml,
=0.1L,即100ml,
故答案为:2;2;100.
点评:本题考查物质的量浓度的计算,题目难度不大,注意有关计算公式的运用.
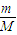 计算物质的量,根据c=
计算物质的量,根据c=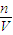 计算物质的量浓度,根据反应H++OH-=H2O计算硫酸的体积,
计算物质的量浓度,根据反应H++OH-=H2O计算硫酸的体积,解答:解:n(NaOH)=
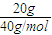 =0.5mol,
=0.5mol,c(NaOH)=
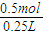 =2mol/L,
=2mol/L,取出5mL该溶液,它的物质的量浓度不变,仍为2mol/L,其中含n(OH-)=0.005L×2mol/L=0.01mol,
根据反应H++OH-=H2O可知:
n(H+)=n(OH-)=0.01mol,
所以H+浓度为0.1mol/L的硫酸溶液的体积为:V=
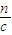 =
=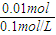 =0.1L,即100ml,
=0.1L,即100ml,故答案为:2;2;100.
点评:本题考查物质的量浓度的计算,题目难度不大,注意有关计算公式的运用.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目