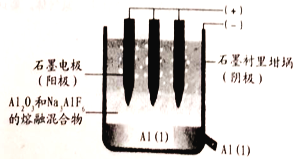
题目内容
【题目】铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0kJ/mol,
C(s)+2H2O(g)=CO2(g)+2H2(g) △H=113.4kJ/mol;
写出FeO(s)和H2O(g)生成Fe3O4(s)和H2(g)的热化学方程式:___________。
(2)以H2、O2、熔融Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.
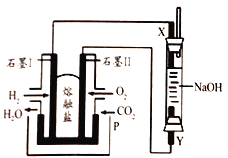
①石墨II电极的名称是______(填“正极”或“负极”);
石墨I电极上的电极反应式为__________。
②Y电极的电极材料是_________;X电极的电极反应式为_________。
通电一段时间后,若右侧玻璃管中产生1molFe(OH)2白色沉淀,理论上P端通入的CO2在标准状况下的体积至少为_____L。
【答案】 3FeO(s)+H2O(g)= Fe3O4(s)+ H2(g) ΔH=18.7 kJ·mol一1 正极 H2-2e-+CO![]() =CO2+H2O Fe或铁 2H2O+2e-=H2↑+2OH- 22.4
=CO2+H2O Fe或铁 2H2O+2e-=H2↑+2OH- 22.4
【解析】(1)6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0kJ/mol,C(s)+2H2O(g)=CO2(g)+2H2(g) △H=113.4kJ/mol;两热化学方程式相加除以2得:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)△H=(-76.0kJ·mol-1+113.4kJ·mol-1)÷2=+18.7kJ·mol-1,热化学方程式:3FeO(s)+H2O(g)= Fe3O4(s)+ H2(g) ΔH=18.7 kJ·mol一1 ;(2)①石墨II电极上氧气得电子,是原电池的正极;石墨电极Ⅰ是通入氢气发生的还原反应,氢气得到电子在熔融盐Na2CO3组成燃料电池中反应生成水,依据电荷守恒配平书写电极反应为:H2-2e-+CO32-═CO2+H2O;②阳极Y必须是铁电极,Fe-2e-=Fe2+,X电极与负极相连作电解池的阴极,阴极发生的反应是溶液中的氢离子得到电子生成氢气,碱溶液中电极反应:2H2O+2e-=H2↑+2OH-;通电一段时间后,若右侧玻璃管中产生1molFe(OH)2白色沉淀,理论上P端通入的CO2在标准状况下的体积:由关系式Fe(OH)2~2e-~H2~CO2,产生1molFe(OH)2,P端通入的1molCO2,即通入标准状况下22.4LCO2。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】已知有机物A、C、D、F具有下列性质:
物质 | 性质 |
A | 属于酯类化合物 |
C | 含有4类氢原子 |
D | 只含有一个氧原子,与Na反应放出H2 |
F | 属于烃 |
转化关系如图所示:
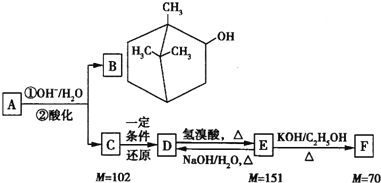
请回答下列问题:
(1)B的分子式为 ____________。
(2)B不能发生的反应是 (_______)(填序号)。
a.氧化反应 b.聚合反应 c.消去反应 d.取代反应 e.与Br2加成反应
(3)写出D→E、E→F的反应:
D→E ____________________________ ;
E→F______________________________。