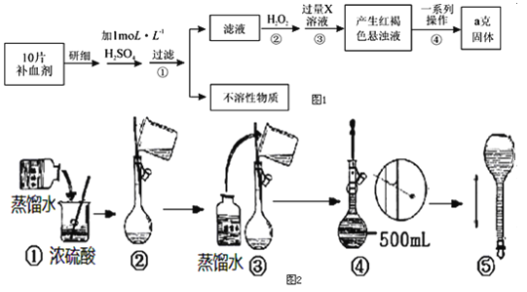
题目内容
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
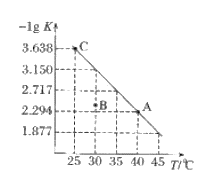
A. 该反应的△H>0
B. C点对应状态的平衡常数K(C)=103.638
C. NH3的体积分数不变时,该反应一定达到平衡状态
D. 30℃时,B点对应状态的![]()
【答案】C
【解析】
由图象可知,升高温度,平衡常数的负对数减小,说明升高温度K增大,平衡正向移动,则正反应为吸热反应,由化学方程式可知反应得到NH3、CO2的物质的量之比为2:1,反应开始后氨气体积分数始终不变,结合浓度商与平衡常数的关系判断反应的方向,以此解答该题。
A.-lgK越大,则平衡常数K越小,由图可知,随温度升高,平衡常数增大,则升高温度平衡正向移动,正反应为吸热反应,故该反应的△H>0,故A正确B.C点-lgK=3.638,则平衡常数K=10-3.638,故B正确;C.反应得到NH3、CO2的物质的量之比为2:1,反应开始后氨气体积分数始终不变,NH3的体积分数不变不能说明该反应达到平衡状态,故C错误;D.B点浓度商大于平衡常数,反应向逆反应进行,则B点对应状态的υ(正)<υ(逆),故D正确;故答案为C。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 植物油和溴水混合后振荡、静置 | 溶液分层,溴水褪色 | 植物油萃取了溴水中的Br2 |
B | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液中 | 溶液变黄色 | H2O2的氧化性比Fe3+弱 |
C |
| 出现白色沉淀 | 氨气、二氧化碳与饱和食盐水反映生成碳酸钠 |
D | 将盛有铜与浓硫酸的试管加热,发现试管底部出现白色固体,倒去试管中液体,再加入适量水 | 白色固体溶解,溶液显蓝色 | 白色固体为无水硫酸铜 |
A. AB. BC. CD. D