题目内容
将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应。求:
(1)所用盐酸中HCl的物质的量浓度
(2)反应中生成的H2在标准状况下的体积
(3)在反应后的溶液中通入Cl2,写出所发生反应的化学方程式并用双线桥标出电子转移的方向和数目:
(1)所用盐酸中HCl的物质的量浓度
(2)反应中生成的H2在标准状况下的体积
(3)在反应后的溶液中通入Cl2,写出所发生反应的化学方程式并用双线桥标出电子转移的方向和数目:
(1)C(HCl)= 2mol·L-1(2分)
(2) V(H2)=4.48L(2分)
(3)2FeCl2+Cl2=2FeCl3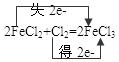 (方程式写对2分,双线桥表示2分)
(方程式写对2分,双线桥表示2分)
(2) V(H2)=4.48L(2分)
(3)2FeCl2+Cl2=2FeCl3
 (方程式写对2分,双线桥表示2分)
(方程式写对2分,双线桥表示2分)试题分析:Fe + 2HCl=FeCl2 + H2↑
56 2 22.4
11.2g n(HCl) v(H2)
所以C(HCl)=
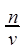 =2mol·L-1, v(H2)=4.48L
=2mol·L-1, v(H2)=4.48L
练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
 与
与 离子总数为0.2NA
离子总数为0.2NA