题目内容
【题目】在密闭容器中,对于可逆反应A+3B![]() 2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )
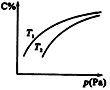
A. 若正反应方向ΔH<0,则T 1 >T 2
B. 压强增大时,混合气体的平均相对分子质量减小
C. B一定为气体
D. A一定为气体
【答案】C
【解析】A. 若正反应方向ΔH<0,升高温度平衡向逆反应方向进行,C的体积分数减小,则T 1 <T 2,A错误;B. 压强增大时C的体积分数增加,平衡向正反应方向进行,由于气体的质量可能增加,也可能不变,但混合气体的物质的量是减少的,因此混合气体的平均相对分子质量增加,B错误;C. 压强增大时C的体积分数增加,平衡向正反应方向进行,即正反应是体积减少的,所以根据方程式可判断B一定为气体,A可能是气体,C正确;D. 根据C中分析可知A不一定为气体,D错误,答案选C。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】.甲醇作为一种较好的可再生能源,具有广泛的应用前景。
已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) ![]() CH3OH(g) H1=-90kJ·mol-1
CH3OH(g) H1=-90kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g) + H2(g) H2=-41kJ·mol-1
CO2(g) + H2(g) H2=-41kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:___________________。
Ⅱ. 已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度 | ||
500℃ | 700℃ | 800℃ | ||
2H2(g) + CO(g) | K1 | 2.5 | 0.34 | 0.15 |
H2(g) + CO2(g) | K2 | 1 | 1.7 | 2.52 |
3H2(g)+CO2(g) | K3 | |||
请回答下列问题:
(1)反应①是__________(填“吸热”或“放热“)反应
(2)观察①②③可推导出K1、K2、K3之间的关系,则K3=_______(用K1、K2表示)
(3)某温度时,反应①式中各物质的平衡浓度符合下式:20×c(CH2OH)=3×c(CO)×c3(H2),试判断此时的温度为____________。
(4)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.4 mol· L-1、1 mol·L-1、0.5 mol·L-1、0.4 mol·L-1molL-1,则此时V(正)______V(逆)(填“>”、 “=”或“<”)。
(5)对应反应③,一定条件下将H2(g)和CO2(g)以体积比3:1置于恒温恒容的密闭容器发生反应,下列能说明该反应达平衡状态的有_____________。
A.体系密度保持不变
B.H2和CO2的体积比保持不变
C.混合气体的平均相对分子量不变时,反应一定达到平衡状态
D.当破坏CO2中2个碳氧双键,同时破坏H2O中的2个氧氢键,反应一定达到平衡状态