题目内容
【题目】有一包白色粉末X,由BaCl2、K2SO4、CaCO3、NaOH、CuCl2、KCl中的一种或几种组成,为了探究其成分,进行了如下实验:
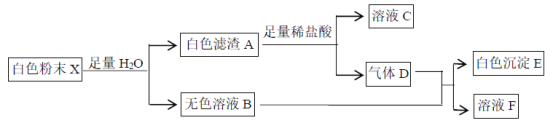
下列判断正确的是
A. 白色滤渣A可能为CaCO3、BaSO4的混合物
B. K2SO4、CuCl2一定不存在
C. KCl、K2SO4可能存在
D. CaCO3、BaCl2一定存在,NaOH可能存在
【答案】B
【解析】
由流程可知,白色固体溶于水,得到无色溶液,则一定不含CuCl2,白色滤渣A与足量稀盐酸反应生成气体D和溶液C,则滤渣A为CaCO3,不含BaSO4,生成的气体D为CO2;CO2与无色溶液B反应生成白色沉淀E和溶液F,则白色沉淀E为BaCO3,则一定含有BaCl2、NaOH,一定没有K2SO4;可能存在KCl;据此分析解答。
A.白色滤渣A只有CaCO3,不存在BaSO4,因为加入足量稀盐酸后没有沉淀剩余,故A错误;
B.结合分析可知,原混合物中一定不存在K2SO4、CuCl2,故B正确;
C.根据上述分析,可能含有KCl,一定不存在K2SO4,故C错误;
D.如果没有NaOH,BaCl2与二氧化碳不反应,无法生成碳酸钡沉淀,则一定含有NaOH,故D错误;
故选B。

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
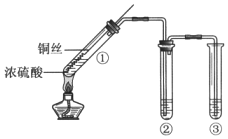
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
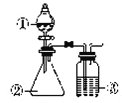
选项 | ① | ② | ③ | 实验结论 |
A | 酸性高锰酸钾 | 浓盐酸 | NaHCO3溶液 | Cl2与水反应生成酸性物质 |
B | 浓硫酸 | 蔗糖 | 澄清石灰水 | 浓硫酸具有脱水性、氧化性 |
C | 浓硝酸 | 铁片 | NaOH溶液 | 铁和浓硝酸反应可生成NO |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D