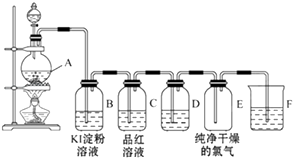
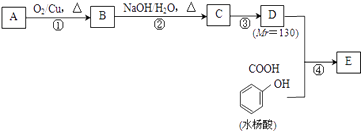
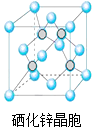
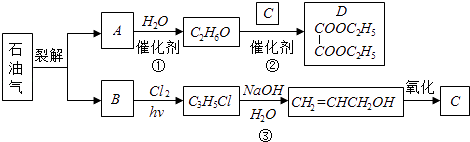
题目内容
【题目】某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧更旺,因此该同学得出结论“煤炭燃烧时加少量水,可使煤炭燃烧放出更多的热量.”(已知煤炭的燃烧热为﹣393.15kJ/mol,氢气的燃烧热为﹣242kJ/mol,一氧化碳的燃烧热为﹣283kJ/mol)
(1)写出该同学看到燃烧现象所涉及到的所有热化学反应方程式;、、、
(2)你认为该同学的结论是否正确,请简要说明理由. .
【答案】
(1)C (s)+O2 (g)=CO2(g)△H=﹣393.15 kJ/mol;H2 (g)+ ![]() O2 (g)=H2O (l)△H=﹣242kJ/mol;CO (g)+
O2 (g)=H2O (l)△H=﹣242kJ/mol;CO (g)+ ![]() O2 (g)=CO2(g)△H=﹣283 kJ/mol;C (s)+H2O (l)=CO(g)+H2 (g)△H=+131.85 kJ/mol
O2 (g)=CO2(g)△H=﹣283 kJ/mol;C (s)+H2O (l)=CO(g)+H2 (g)△H=+131.85 kJ/mol
(2)不正确;因为根据盖斯定律,反应过程中的热效应与途径无关,只与反应物和生成物的能量差有关
【解析】解:已知煤炭的燃烧热为﹣393.15kJ/mol,氢气的燃烧热为﹣242kJ/mol,一氧化碳的燃烧热为﹣283kJ/mol;上述反应过程中包括碳燃烧、碳和水的反应,氢气燃烧,一氧化碳燃烧,依据燃烧热概念写出热化学方程式,依据盖斯定律写出碳和水蒸气反应的热化学方程式;①C (s)+O2(g)=CO2(g)△H=﹣393.15 kJ/mol;②H2(g)+ ![]() O2 (g)=H2O (l)△H=﹣285.8kJ/mol③CO (g)+
O2 (g)=H2O (l)△H=﹣285.8kJ/mol③CO (g)+ ![]() O2 (g)=CO2(g)△H=﹣283 kJ/mol④依据盖斯定律,①﹣②﹣③得到:C (s)+H2O (l)=CO(g)+H2 (g)△H=+175.65 kJ/mol;所以答案是:C (s)+O2 (g)=CO2(g)△H=﹣393.15 kJ/mol;H2 (g)+
O2 (g)=CO2(g)△H=﹣283 kJ/mol④依据盖斯定律,①﹣②﹣③得到:C (s)+H2O (l)=CO(g)+H2 (g)△H=+175.65 kJ/mol;所以答案是:C (s)+O2 (g)=CO2(g)△H=﹣393.15 kJ/mol;H2 (g)+ ![]() O2 (g)=H2O (l)△H=﹣242kJ/molCO (g)+
O2 (g)=H2O (l)△H=﹣242kJ/molCO (g)+ ![]() O2 (g)=CO2(g)△H=﹣283 kJ/molC (s)+H2O (l)=CO(g)+H2 (g)△H=+131.85 kJ/mol;(2)通过分析可知,反应的焓变只与反应物和生成物的能量有关,与反应途径无关,所以煤炭燃烧时加少量水,煤炭燃烧放出的热量多不正确;所以答案是:不正确;因为根据盖斯定律,反应过程中的热效应与途径无关,只与反应物和生成物的能量差有关;
O2 (g)=CO2(g)△H=﹣283 kJ/molC (s)+H2O (l)=CO(g)+H2 (g)△H=+131.85 kJ/mol;(2)通过分析可知,反应的焓变只与反应物和生成物的能量有关,与反应途径无关,所以煤炭燃烧时加少量水,煤炭燃烧放出的热量多不正确;所以答案是:不正确;因为根据盖斯定律,反应过程中的热效应与途径无关,只与反应物和生成物的能量差有关;

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】下列实验操作及其结论都正确的是( )
Ⅰ操作 | Ⅱ结论 | |
A | 滴加Ba(OH)2溶液生成白色沉淀 | 原溶液中有SO |
B | 滴加AgNO3溶液生成白色沉淀 | 原溶液中有Cl﹣ |
C | 滴加过量浓NaOH溶液并加热,将湿润红色石蕊试纸置于试管口,试纸变蓝色 | 原溶液中有NH |
D | 滴加氯水和CCl4 , 振荡、静置,上层溶液显紫红色 | 原溶液中有I﹣ |
A.A
B.B
C.C
D.D