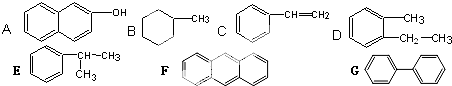
题目内容
下列现象与氢键有关的是( )
①H2O的沸点比H2Te的沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑤水分子在高温下也很稳定.
①H2O的沸点比H2Te的沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑤水分子在高温下也很稳定.
| A、①②③④ | B、①②③⑤ |
| C、①②③ | D、①②③④⑤ |
考点:含有氢键的物质
专题:化学键与晶体结构
分析:氢键广泛存在于非金属性较强的元素F、O、N等元素形成的含氢化合物中,有机物中氢键的存在,分子间具有较强的作用力,则物质的熔沸点较高,另外氢键具有方向性和饱和性.
解答:
解:①O的电负性较大,对应的氢化物可形成氢键,沸点较高,故①正确;
②小分子的醇、羧酸可以和水分子之间形成氢键,溶解度较大,故②正确;
③水为液态时,水分子间氢键是无规则的,分子相对密集,而固态的冰分子间氢键很规则,整体成空间网状结构,从而使分子间距离变大使水密度变小,所以冰的密度比液态水的密度小与氢键的存在有关,故③正确;
④对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,故④正确;
⑤水分子在高温下也很稳定,是由于共价键键能较大,与氢键无关,故⑤错误.
故选A.
②小分子的醇、羧酸可以和水分子之间形成氢键,溶解度较大,故②正确;
③水为液态时,水分子间氢键是无规则的,分子相对密集,而固态的冰分子间氢键很规则,整体成空间网状结构,从而使分子间距离变大使水密度变小,所以冰的密度比液态水的密度小与氢键的存在有关,故③正确;
④对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,故④正确;
⑤水分子在高温下也很稳定,是由于共价键键能较大,与氢键无关,故⑤错误.
故选A.
点评:本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,注意氢键和化学键的区别,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式正确的是( )
| A、常温下,将铁片置于过量的浓硝酸中:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O | ||||
B、加热条件下,铜与浓硫酸反应:4H++SO42-+Cu
| ||||
| C、常温下,向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ | ||||
| D、常温下,向稀硝酸中加入过量的铁片:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
亮菌甲素为利胆解痉药适用于急性胆囊炎治疗等,其结构简式如图所示下列有关叙述正确的是( )


| A、亮菌甲素分子式为C12H11O5 |
| B、亮菌甲素能与三氯化铁溶液发生显色反应,1mol最多能与5mol H2发生加成反应 |
| C、1mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗2mol NaOH |
| D、每个亮菌甲素分子在一定条件下与足量H2反应后的产物有3个手性碳原子 |
某有机物的结构简式如图所示,下列说法中不正确的是( )
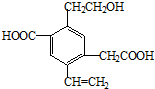

| A、1mol该有机物和过量的金属钠反应最多可以生成1.5mol H2 |
| B、该物质消耗Na、NaOH、NaHCO3的物质的量之比为3:2:2 |
| C、可以用酸性高锰酸钾溶液检验其中的碳碳双键 |
| D、该物质能够在催化剂作用下被氧化为醛 |
下列文字表述与反应方程式对应不正确的是( )
| A、氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | ||
| B、用醋酸除去水垢:CaCO3+2CH3COOH═Ca2++2CH3COO--+H2O+CO2↑ | ||
| C、将丙烯通入溴水中:CH3-CH═CH2+Br2→CH3CHBrCH2Br | ||
D、甲烷与氧气反应:CH4+2O2
|
下列关于可逆反应达到平衡状态的描述,正确的是( )
| A、反应停止 |
| B、正、逆反应速率都为零 |
| C、各物质浓度不再改变 |
| D、反应物的浓度为零 |
下列对硫酸的叙述错误的是( )
| A、硫酸是强酸 |
| B、浓硫酸具有氧化性 |
| C、浓硫酸可作干燥剂 |
| D、稀释浓硫酸时,边搅拌浓硫酸边慢慢地加水 |
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A、K+、MnO4-、Na+、Cl- |
| B、K+、Ba2+、NO3-、Cl- |
| C、Na+、HCO3-、NO3-、SO42- |
| D、Fe3+、Na+、Cl-、SO42- |