题目内容
实验是化学的基础.某学习小组设计并进行了下述两个实验.
(1)探究KI溶液和FeCl3溶液反应存在一定的限度.
可选试剂:
①0.1 mol·L-1 KI溶液
②0.1 mol·L-1
FeCl3溶液
③FeCl2溶液
④盐酸
⑤KSCN溶液
⑥CCl4
实验步骤:
①取5 mL 0.1 mol·L-1 KI溶液,滴加5~6滴0.1 mol·L-1 FeCl3溶液;
②充分反应后,将溶液分成两份;
③取其中一份,滴加CCl4,充分振荡,静置,CCl4层呈紫红色,说明反应生成碘.
④另取一份,滴加试剂________,现象________,说明________.
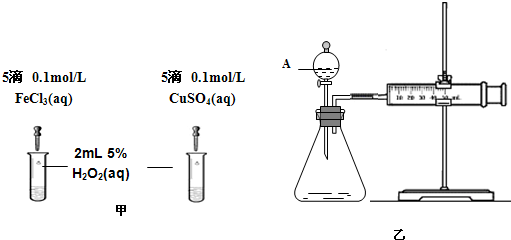
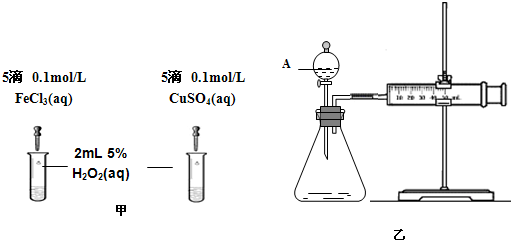
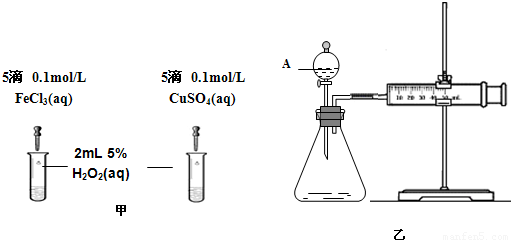
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.请回答下列问题:

①定性分析:如图甲可通过观察________,定性比较得出结论;有同学提出将CuSO4改为CuCl2更为合理,其理由是________.
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,实验中需要测量的数据是________.
答案:
解析:
解析:
|
(1)④KSCN溶液(即⑤),溶液显红色, 说明溶液中还有Fe3+; (2)①产生气泡的快慢, 排除因阴离子的不同可能带来的影响. ②收集40 mL气体所需的时间. |

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目