题目内容
【题目】氧化钠和过氧化钠是钠的两种氧化物,请回答下列问题。
(1)写出过氧化钠与二氧化碳反应的化学方程式,并用双线桥法分析电子转移的方向和数目。______________________________________________________________
(2)标准状况下,如果反应中有4.48L的O2生成,转移的电子数为_____________。
(3)在呼吸面具和潜水艇里,用作氧气来源的物质是________。
A.Na2O B.KClO3 C.Na2O2 D.KMnO4
(4)把Na2O2投入紫色石蕊的稀溶液中,会出现什么现象?______________________________。
【答案】 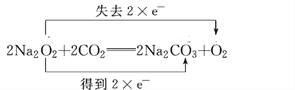 2.408×1023 C 石蕊溶液先变为蓝色,后变为无色
2.408×1023 C 石蕊溶液先变为蓝色,后变为无色
【解析】(1).过氧化钠与二氧化碳反应生成碳酸钠和二氧化碳,过氧化钠中氧元素的化合价部分从-1价升高到0价,部分化合价从-1价降低到-2价,每生成1mol氧气转移2mol电子,根据得失电子守恒,用双线桥法表示的式子为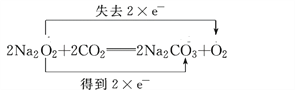 ,故答案为:
,故答案为: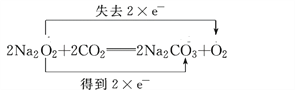 ;
;
(2).根据上述分析可知,在2Na2O2+2CO2=2Na2CO3+O2反应中,每生成1molO2,转移2mol电子,标准状况下,如果反应中有4.48L的O2生成,n(O2)=4.48L÷22.4L/mol=0.2mol,则转移电子的物质的量为0.4mol,数目为0.4mol×6.02×1023mol-= 2.408×1023,故答案为:2.408×1023;
(3)Na2O与CO2反应生成Na2CO3,没有O2生成,故A错误;KClO3和KMnO4分解生成O2时需要加热,不适合呼吸面具和潜水艇中使用,故B和D错误;Na2O2为固体,携带方便,且能与人呼吸产生的CO2反应生成氧气,该反应不需要加热也不需要催化剂,适宜在呼吸面具和潜水艇中作供氧剂,故C正确,答案选C;
(4). 把Na2O2投入紫色石蕊的稀溶液中,Na2O2与H2O反应产生NaOH使石蕊试液变蓝,同时Na2O2具有强氧化性能漂白溶液,又会使蓝色退去,故答案为:石蕊溶液先变为蓝色,后变为无色。

 阶梯计算系列答案
阶梯计算系列答案