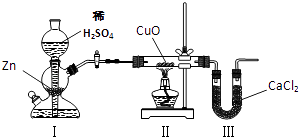
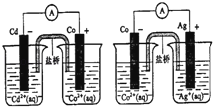
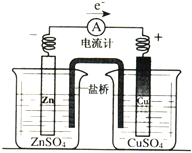
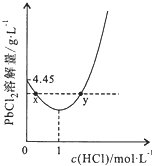
��Ŀ����
����Ŀ����18molL��1Ũ��������100mL3.0molL��1ϡ�����ʵ�鲽�����£�
�ټ�������Ũ��������������ȡһ�������Ũ������ܽ⣻����ȴ����ת�ơ�ϴ�ӣ������ݡ�ҡ�ȣ� ��װƿ����ǩ��
����������⣺
��1������Ũ���������� �� ��ȡŨ�������õ���Ͳ�Ĺ��������������ѡ��A��10mL��B��25mL��C��50mL��D��100mL����
��2���ڢ۲�ʵ��IJ����� ��
��3����������������Ƶ�ϡ����Ũ���к�Ӱ�죿���á�ƫ��ƫС������Ӱ�족��д��
A�����õ�Ũ���᳤ʱ��������ܷⲻ�õ���������
B������ƿ������ˮϴ�Ӻ������������ˮ��
C�����ù����ձ���������δϴ����
D������ʱ���ӿ̶��� ��
���𰸡�
��1��16.7mL,B
��2�������ձ�����30mL��������������ˮ,Ȼ��Ũ�������ձ��ڱڻ��������ձ���,���ò���������
��3��ƫС,��Ӱ��,ƫС,ƫ��
���������⣺��1����Һϡ��ǰ�����ʵ����ʵ������䣬����ҪŨ��������ΪV��18molL��1��V�T100mL��3.0molL��1�����V=16.7ml��Ӧѡ��25ml����Ͳ��
��2��ϡ��Ũ����Ӧ��Ũ��������ע��ˮ�У������Ͻ��裬��ֹ�Ž���
��3���������ʵ���Ũ�ȶ���C= ![]() ����������ʹ���ʵ���nƫС����ʹVƫ��IJ�������ʹ��Һ�����ʵ���Ũ��ƫС����֮����Һ�����ʵ���Ũ��ƫ��
����������ʹ���ʵ���nƫС����ʹVƫ��IJ�������ʹ��Һ�����ʵ���Ũ��ƫС����֮����Һ�����ʵ���Ũ��ƫ��
A��Ũ���������ˮ�ԣ����õ�Ũ���᳤ʱ��������ܷⲻ�õ������У�Ũ�����Ũ�ȱ�ϡ��ʵ����ȡ��Ũ������������������ʵ���ƫС��������Һ��Ũ��ƫС��
B����Һ�������ˮ���ݣ�����ƿ������ϴ�Ӻ������������ˮ����������ҺŨ����Ӱ�죻
C�����ù����ձ���������δϴ�ӣ���������մ���ձ��ڡ��������ϣ���������ƿ����������ʵ������٣�������ҺŨ��ƫС��
D������ʱ���ӿ̶��ߣ�����Һ���ڿ̶������£���Һ�����ƫС��������Һ��Ũ��ƫ��
�ʴ�Ϊ����1��16.7mL��B����2�������ձ�����30mL ��������������ˮ��Ȼ��Ũ�������ձ��ڱڻ��������ձ��У����ò��������裻��3��ƫС����Ӱ�죻ƫС��ƫ��
��1����Ũ��Һ����ϡ��Һ��һ�����ϡ�Ͳ�����ϡ�����У����ʵ������ֲ������ݹ�ʽ![]() ���м��㣻��Ͳ��ȡ��Ӧ�������õ���Һ���������Ͳ�����̡�
���м��㣻��Ͳ��ȡ��Ӧ�������õ���Һ���������Ͳ�����̡�
��2��Ũ�����ϡ��Ӧ��Ũ�������ձ�������ע��ˮ�У������Ͻ��衣
��3��A.Ũ���������ˮ�ԣ����ڳ��ڷ��ú������Ũ���ᣬ���е����ʵ�����С��
B.����ƿ�ײ���ˮ����Ӱ����Һ�����ƣ�
C.�ձ�������������մ����Һ��δϴ�ӻᵼ�����ʱ��٣�
D.���ӿ̶��ߣ�ʵ��Һ�������С�ڿ̶��ߣ�

 ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�