题目内容
【题目】(1)0.3molNH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有______________(填“氧化性”或“还原性”);
(3)现有一含有FeCl2 和FeCl3的混合样品,实验测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3 的物质的量分数为_________。
(4)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子:
a. 取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,
取滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是_________,
b. 原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_________。
A.Cl- B.NO3- C.CO32- D.OH-
【答案】0.4NA 还原性 10% Ag+、Mg2+ B
【解析】
(1)根据n = ![]() 再结合分子构成分析计算;
再结合分子构成分析计算;
(2)防止食品被氧气氧化,则防腐剂具有还原性;
(3)根据元素守恒计算氯化亚铁和氯化铁物质的量之比,进而计算氯化铁质量分数;
(4)a. AgCl为不溶于稀硝酸的白色沉淀,加入过量NaOH溶液,出现白色沉淀,应为Mg(OH)2;
b. 根据上一问可知,溶液中存在的阳离子为Ag+和Mg2+,则结合离子共存的条件采用排除法作答。
(1)0.3mol NH3分子中含有的原子的物质的量为0.3 mol×4 = 1.2mol,则n(H2O) = ![]() = 0.4 mol,二者含有的原子个数相等,N(H2O) = 0.4mol × NA/mol = 0.4 NA个,
= 0.4 mol,二者含有的原子个数相等,N(H2O) = 0.4mol × NA/mol = 0.4 NA个,
故答案为:0.4 NA;
(2)防止食品被氧气氧化,则防腐剂具有还原性,
故答案为:还原性;
(3)设混合物中FeCl2物质的量为x,FeCl3的物质的量为y,则![]() = 12.1,得到x:y=9:1,氯化铁物质的量分数 =
= 12.1,得到x:y=9:1,氯化铁物质的量分数 = ![]() ×100% = 10%;
×100% = 10%;
故答案为:10%;
(4)a. 过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有Ag+离子,反应的离子方程式为Ag++Cl═AgCl↓,在除去Ag+离子的溶液中,加入过量NaOH溶液,出现白色沉淀,则原溶液中一定存在Mg2+,
故答案为:Ag+、Mg2+;
b. 原溶液中存在的阳离子为Ag+和Mg2+,则Cl-与Ag+不共存,CO32-、OH-与溶液中的两种阳离子均不共存,故排除A、C、D选项,B项中NO3-与Ag+和Mg2+均不反应,可大量共存,故选B,
答案为:B。

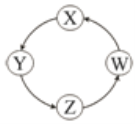
【题目】图示表示物质X、Y、Z、W在一定条件下可以按照箭头一步转化。
序号 | X | Y | Z | W |
|
(1) | |||||
(2) |
|
| |||
(3) |
|
|
(1)X是金属单质,焰色反应呈黄色;Y的纯净物易潮解;Z可用于治疗胃酸过多;X在黄绿色的气体中燃烧可以产生白烟W(已知:电解熔融态的W可以得到X)。
X是:___________Y是:___________Z是:__________W是:__________(填写化学式)
(2)Z具有漂白性,但是不稳定,易分解产生含氯化合物。Z是:________(填写化学式)
(3)鉴别X、Y可以滴加___________溶液,前者出现血红色。(填写名称)
【题目】已知常温下,几种难溶电解质的溶度积(Ksp):
化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀