题目内容
将主族元素X的最高价氧化物X2O
解析:设X的相对原子质量为M(X),Y的相对原子质量为M(Y)。
由 X2O+H2O![]() 2XOH
2XOH
即![]() ,M(X)=39,X为钾元素;
,M(X)=39,X为钾元素;
又已知n(HCl)=0.75 mol·L-1×
YOH+HCl![]() YCl+H2O
YCl+H2O
M(Y)+17 1 mol
∴![]() ,M(Y)=23,Y为钠元素;
,M(Y)=23,Y为钠元素;
ZO2的摩尔质量为![]() ×
×![]() 。
。
答案:X、Y、Z的相对原子质量分别为:39,23,32,电子式分别为K·,Na·,![]() 。
。

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
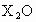 4.7g溶于95.3g水中,所得溶液
4.7g溶于95.3g水中,所得溶液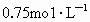 的盐酸恰好中和.Z与Y在同一周期,标准状况下5.6L
的盐酸恰好中和.Z与Y在同一周期,标准状况下5.6L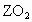 气体的质量为16g.求X、Y、Z的原子量,并分别写出它们的电子式.
气体的质量为16g.求X、Y、Z的原子量,并分别写出它们的电子式.