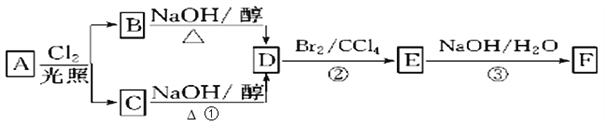
题目内容
【题目】工业上用铝土矿(主要成分Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
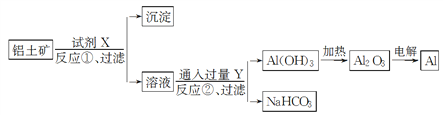
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为Fe2O3
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
【答案】BD
【解析】A.由溶液乙通入过量的Y生成氢氧化铝沉淀、碳酸氢钠可知,溶液乙中含有偏铝酸根、气体Y为二氧化碳,故试剂X为氢氧化钠溶液,不可能为盐酸,故A错误;B.Al2O3溶于氢氧化钠溶液得到NaAlO2溶液,Fe2O3与氢氧化钠溶液不反应,则过滤后所得沉淀为Fe2O3,故B正确;C.电解熔融Al2O3属于氧化还原反应,故C错误;D.反应①过滤后所得溶液乙为NaAlO2溶液,向NaAlO2溶液中通入过量CO2生成Al(OH)3沉淀,反应的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,故D正确;答案为BD。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表:
X | Y | Z | M | R | Q | |
原子半径/nm | 0.099 | 0.186 | 0.074 | 0.143 | ||
主要化合价 | +4,-4 | -2 | -1,+7 | +3 | ||
其他 | 常温下为黄色固体 | 无机非金属材料的主角 | 颜色反应为黄色 | 其氧化物可做耐火材料 |
(1)Q在元素周期表中的位置是______.
(2)Y与R相比,非金属性较强的是________(用元素符号表示),下列事实能证明这一结论的是______(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:HR>YH4
c.Y与R形成的化的中Y呈正价
(3)根据表中数据推测,Y的原子半径的最小范围是______.
(4)甲、乙是上述某些元素的最高价氧化物对应的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是______.
(5)已知1mo1XM2(g)被氧化为1mo1XM3(g)的△H=﹣99kJ/mo1.写出由XM2生成XM3的热化学反应方程式 ________。