题目内容
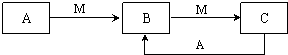
(2012?泉州二模)已知甲和乙在溶液中的转化关系如图1所示:
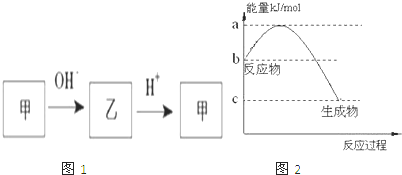
请回答下列问题:
(1)若甲是10电子的单核微粒,乙是两性氢氧化物,则微粒甲的结构示意图为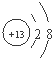
 .
.
(2)若甲是10电子的阳离子,乙是碱性气体.1mol乙通入足量强酸溶液中与H+反应,反应过程中能量变化如图2:写出乙的一种用途:
(3)若甲是CrO42-(黄色)和Cr2O72-(橙色)的混合溶液,在该溶液中存在如下平衡:CrO42-(黄色)+2H+? Cr2O72-(橙色)+H2O若测得甲溶液的pH=1,该溶液显
(4)若甲仅含有NO3-、SO42-和X三种离子,则X离子可能是
A.Fe2+ B.HCO3- C.Ba2+ D.Fe3+
(5)若甲是CO2,乙中HCO3-和CO32-的物质的量浓度相等,此时溶液的pH=10,则HCO3-的电离平衡常数Ka=

请回答下列问题:
(1)若甲是10电子的单核微粒,乙是两性氢氧化物,则微粒甲的结构示意图为
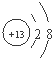
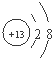
(2)若甲是10电子的阳离子,乙是碱性气体.1mol乙通入足量强酸溶液中与H+反应,反应过程中能量变化如图2:写出乙的一种用途:
制氮肥
制氮肥
;该反应的热化学方程式是NH3(g)+H+(aq)═NH4+(aq)△H=-(b-c)kJ?mol-1
NH3(g)+H+(aq)═NH4+(aq)△H=-(b-c)kJ?mol-1
.(3)若甲是CrO42-(黄色)和Cr2O72-(橙色)的混合溶液,在该溶液中存在如下平衡:CrO42-(黄色)+2H+? Cr2O72-(橙色)+H2O若测得甲溶液的pH=1,该溶液显
橙
橙
色.(4)若甲仅含有NO3-、SO42-和X三种离子,则X离子可能是
D
D
(填序号).A.Fe2+ B.HCO3- C.Ba2+ D.Fe3+
(5)若甲是CO2,乙中HCO3-和CO32-的物质的量浓度相等,此时溶液的pH=10,则HCO3-的电离平衡常数Ka=
10-10
10-10
.分析:(1)乙是两性氢氧化物,应为Al(OH)3,则10电子的单核微粒甲为Al3+;
(2)乙是碱性气体,应为NH3,则甲为NH4+;
(3)根据H+对平衡移动的影响分析;
(4)根据溶液整体呈电中性及考虑离子共存,应为Fe3+;
(5)根据电离平衡常数k=
计算.
(2)乙是碱性气体,应为NH3,则甲为NH4+;
(3)根据H+对平衡移动的影响分析;
(4)根据溶液整体呈电中性及考虑离子共存,应为Fe3+;
(5)根据电离平衡常数k=
| c(H+)×c(CO32-) |
| c(HCO3-) |
解答:解:(1)乙是两性氢氧化物,应为Al(OH)3,则10电子的单核微粒甲为Al3+,结构示意图为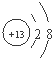 ,故答案为:
,故答案为: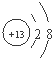 ;
;
(2)乙是碱性气体,应为NH3,则甲为NH4+,常用于制造氮肥,根据图中信息分析,反应为吸热反应,
反应的热化学方程式是NH3(g)+H+(aq)═NH4+(aq)△H=-(b-c)kJ?mol-1,
故答案为:制氮肥;NH3(g)+H+(aq)═NH4+(aq)△H=-(b-c)kJ?mol-1;
(3)pH=1呈酸性,平衡正向移动,该溶液显橙色,故答案为:橙;
(4)Fe2+在酸性条件下与NO3-发生氧化还原反应被氧化,Ba2+与SO42-反应生成沉淀而不能共存,溶液不可能只含有阴离子,则只能含有Fe3+,
故答案为:D;
(5)pH=10,则c(H+)=10-10mol/L,HCO3-和CO32-的物质的量浓度相等,则HCO3-的电离平衡常数Ka=
=10-10.
故答案为:10-10.
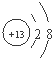 ,故答案为:
,故答案为: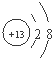 ;
;(2)乙是碱性气体,应为NH3,则甲为NH4+,常用于制造氮肥,根据图中信息分析,反应为吸热反应,
反应的热化学方程式是NH3(g)+H+(aq)═NH4+(aq)△H=-(b-c)kJ?mol-1,
故答案为:制氮肥;NH3(g)+H+(aq)═NH4+(aq)△H=-(b-c)kJ?mol-1;
(3)pH=1呈酸性,平衡正向移动,该溶液显橙色,故答案为:橙;
(4)Fe2+在酸性条件下与NO3-发生氧化还原反应被氧化,Ba2+与SO42-反应生成沉淀而不能共存,溶液不可能只含有阴离子,则只能含有Fe3+,
故答案为:D;
(5)pH=10,则c(H+)=10-10mol/L,HCO3-和CO32-的物质的量浓度相等,则HCO3-的电离平衡常数Ka=
| c(H+)×c(CO32-) |
| c(HCO3-) |
故答案为:10-10.
点评:本题考查较为综合,在无机物的推断的基础上考查物质的结构、热化学方程式、化学平衡以及弱电解质的电离等问题,题目难度中等.

练习册系列答案
相关题目
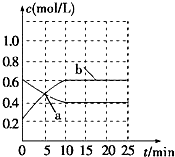 (2012?泉州二模)已知:2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4的混合气体通入恒温密闭容器中,反应体系中物质浓度随时间的变化关系如图所示.下列说法正确的是( )
(2012?泉州二模)已知:2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4的混合气体通入恒温密闭容器中,反应体系中物质浓度随时间的变化关系如图所示.下列说法正确的是( )