题目内容
(1)铜是人类最早使用的金属之一,以下是冶炼铜的一个反应:
Cu2S+2Cu2O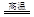 6Cu+SO2
6Cu+SO2
该反应中被氧化的元素是 ,若反应中转移1mol电子,得到Cu mol。
(2)下列两种方法均可以制备CuSO4。
方法一:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
方法二:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①假如某工厂欲生产CuSO4,请选择一种方法,并说明理由:
。
②有同学认为,生成等量的硫酸铜两种方法消耗的能量相同,因为反应都是铜转变为CuSO4,你认为上述说法 (填“正确”或“不正确”),原因是
。
Cu2S+2Cu2O
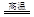 6Cu+SO2
6Cu+SO2该反应中被氧化的元素是 ,若反应中转移1mol电子,得到Cu mol。
(2)下列两种方法均可以制备CuSO4。
方法一:2Cu+O2
 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O方法二:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O①假如某工厂欲生产CuSO4,请选择一种方法,并说明理由:
。
②有同学认为,生成等量的硫酸铜两种方法消耗的能量相同,因为反应都是铜转变为CuSO4,你认为上述说法 (填“正确”或“不正确”),原因是
。
(1)S(或硫)(1分) 1 (1分)
(2)①方法一(1分),硫酸原料利用率高,对环境污染小(1分)
②不正确 (1分) 反应物与产物不完全相同,故反应的热效应不同,消耗的能量也不同(2分)
(2)①方法一(1分),硫酸原料利用率高,对环境污染小(1分)
②不正确 (1分) 反应物与产物不完全相同,故反应的热效应不同,消耗的能量也不同(2分)
试题分析:(1)化合价升高的元素是S,化合价降低的只有Cu 且Cu从+1价到0价,故转移1mole-时得到1molCu
(2)①由方程式可知生成等量的CuSO4需硫酸的量方法一少,且方法一无污染。故答案为:方法一,硫酸原料利用率高,对环境污染小。
②因反应中反应物与产物不完全相同,故反应的热效应不同,消耗的能量也不同,故不正确

练习册系列答案
相关题目