题目内容
 2008年北京奥运会出现了中国自己生产的燃料电池汽车,作为马拉松领跑车和电视拍摄车,该车装着“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示
2008年北京奥运会出现了中国自己生产的燃料电池汽车,作为马拉松领跑车和电视拍摄车,该车装着“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示试回答:
(1)通入氧气的电极发生
(2)电池工作时,正极的电极反应式为
(3)在质子交换膜两侧,质子的运动方向是
a.从左往右 b.从右往左.
考点:原电池和电解池的工作原理
专题:电化学专题
分析:在燃料电池中,通入燃料的电极是负极,该极上发生失电子的氧化反应,通入氧气的电极是正极,该极上氧气得电子发生还原反应,电解质溶液中阳离子向正极移动.
解答:
解:(1)在燃料电池中,通入氧气的电极是正极,该极上氧气得电子发生还原反应,通入氢气的电极为负极;
故答案为:还原;负;
(2)电池工作时,正极上氧气得电子生成水,则正极的电极反应式为O2+4H++4e-═2H2O;
故答案为:O2+4H++4e-═2H2O;
(3)电解质溶液中阳离子向正极移动,则在质子交换膜两侧,质子的运动方向是从左往右,故答案为:a.
故答案为:还原;负;
(2)电池工作时,正极上氧气得电子生成水,则正极的电极反应式为O2+4H++4e-═2H2O;
故答案为:O2+4H++4e-═2H2O;
(3)电解质溶液中阳离子向正极移动,则在质子交换膜两侧,质子的运动方向是从左往右,故答案为:a.
点评:本题考查学生燃料电池的工作原理知识,注意把握正负极的判断、电极方程式的书写、离子移动方向等内容,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
下列各组液体混合物,用分液漏斗不能分开的是( )
| A、乙酸乙酯和水 | B、正已烷和水 |
| C、苯和水 | D、甘油和乙醇 |
下列有机物中,既能发生消去反应,又能发生取代反应和酯化反应的是( )
A、 |
| B、CH3CH2CH2CH2Cl |
| C、HO-CH2-CH2-COOH |
| D、Cl-CH2-COOH |
 近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是( )
近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是( )| A、苹果酸在一定条件下能发生消去反应 |
| B、1mol苹果酸与Na2CO3溶液反应必须消耗2mol Na2CO3 |
| C、苹果酸在一定条件下能发生酯化反应 |
| D、苹果酸在一定条件下能发生催化氧化反应 |
 B.
B. C.
C.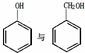
 E.
E. F.2-甲基丁烷和2,2-二甲基丙烷
F.2-甲基丁烷和2,2-二甲基丙烷
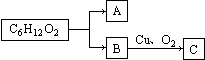
 转变为
转变为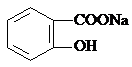 的流程为
的流程为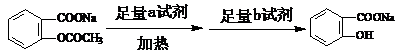
 (1)弱酸HA的电离常数 K=
(1)弱酸HA的电离常数 K= ⑥
⑥ ⑦CH3CHO ⑧HCOOH ⑨
⑦CH3CHO ⑧HCOOH ⑨ ⑩
⑩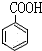

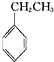 (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g)△H=-166kJ?mol-1
(g)+CO(g)+H2O(g)△H=-166kJ?mol-1