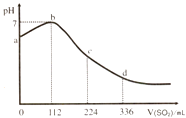
��Ŀ����
����Ŀ���ж�����Ԫ��A��B��C��D��E����֪���ٳ����£�AԪ�صĵ����ڿ�����Ũ�����У����涼���������ܵ�����Ĥ����BԪ�ص�ԭ��������AԪ�ش���ԭ�ӵĴ����ĵ�������������������2������E��Aͬ���ڣ�C��D��E����Ԫ���γɵĵ��ʻ���ɷ�����ͼ��ʾ�ķ�Ӧ�� 
��ش��������⣺
��1��BԪ����EԪ�ص�����������ˮ���������ǿ�����û�ѧʽ��ʾ��������
��2�����û�ѧ����ʽ��ʾEԪ�صĵ����ڹ�ҵ�ϵ�һ����Ҫ��;�� ��
���𰸡�
��1��HClO4��H2SiO3
��2��2Cl2+2Ca��OH��2�TCaCl2+Ca��ClO��2+2H2O
���������⣺������Ԫ��A��B��C��D��E���ٳ����£�AԪ�صĵ����ڿ�����Ũ�����У����涼���������ܵ�����Ĥ����AΪAlԪ�أ���BԪ�ص�ԭ��������AԪ�ش�B���ڵ������ڣ�Bԭ�ӵĴ����ĵ�������������������2��������������Ϊ4����BΪSiԪ�أ���E��Aͬ���ڣ�E�ĵ���Ϊ˫ԭ�ӷ��ӣ�ͨ�������γɣ���EΪClԪ�أ�D��C�γ�DC3 �� Ϊ�����ͽṹ��D�ĵ���ͨ�������γɵ�˫ԭ�ӷ��ӣ���DΪ��Ԫ�ء�CΪ��Ԫ�أ���1��BԪ����EԪ�ص�����������ˮ����ֱ�ΪH2SiO3��HClO4 �� ����Ϊ���ᣬ������Ϊǿ�ᣬ���ԣ�HClO4��H2SiO3 �� ���Դ��ǣ�HClO4��H2SiO3����2�������ڹ�ҵ�Ͽ��������Ʊ�Ư�۵ȣ���Ӧ����ʽΪ��2Cl2+2Ca��OH��2�TCaCl2+Ca��ClO��2+2H2O�����Դ��ǣ�2Cl2+2Ca��OH��2�TCaCl2+Ca��ClO��2+2H2O��