题目内容
Ⅰ.为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计了下列4种实验装置,请回答下列问题:
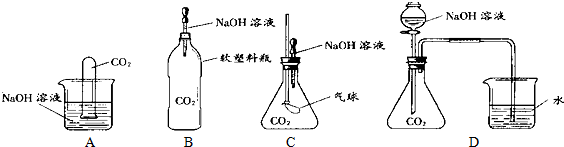
(1)选择实验装置C,简述出现的实验现象以及产生该实验现象的原因: , .
(2)某同学质疑上述所有实验设计,该同学质疑的依据是 .
(3)实验D向锥形瓶中滴入过量的浓NaOH溶液后,滴加 溶液,若出现白色沉淀,说明原实验中生成了CO32-.
Ⅱ.(4)向100mL2mol/L的NaOH 溶液中通入一定量CO2,充分反应后将溶液蒸发结晶,使溶质完全析出,得到白色固体(不考虑结晶水).试设计实验确认该白色固体的成分.
①提出合理假设.
假设1:NaHCO3和Na2CO3; 假设2:只有Na2CO3;
假设3:只有NaHCO3; 假设4: .
②基于假设1,设计实验方案证明固体中含有NaHCO3.(限选实验试剂及仪器:1moL?L-1HCl溶液、0.5moL?L-1BaCl2溶液、1mol?L-1 Ba(OH)2溶液、甲基橙试液、酚酞试液、蒸馏水、试管、过滤装置.
(5)实验小组的同学用盐酸滴定的方法测定白色固体(NaHCO3和Na2CO3)中NaHCO3的物质的量分数.若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时Na2CO3完全转化为NaHCO3.将上述白色固体溶于水配得250ml溶液,取25.00mL 于锥形瓶中用酚酞作指示剂滴定至溶液由红色变无色时消耗0.2000moL?L-1HCl溶液25.00mL.白色固体中NaHCO3的物质的量分数= .

(1)选择实验装置C,简述出现的实验现象以及产生该实验现象的原因:
(2)某同学质疑上述所有实验设计,该同学质疑的依据是
(3)实验D向锥形瓶中滴入过量的浓NaOH溶液后,滴加
Ⅱ.(4)向100mL2mol/L的NaOH 溶液中通入一定量CO2,充分反应后将溶液蒸发结晶,使溶质完全析出,得到白色固体(不考虑结晶水).试设计实验确认该白色固体的成分.
①提出合理假设.
假设1:NaHCO3和Na2CO3; 假设2:只有Na2CO3;
假设3:只有NaHCO3; 假设4:
②基于假设1,设计实验方案证明固体中含有NaHCO3.(限选实验试剂及仪器:1moL?L-1HCl溶液、0.5moL?L-1BaCl2溶液、1mol?L-1 Ba(OH)2溶液、甲基橙试液、酚酞试液、蒸馏水、试管、过滤装置.
| 实验步骤 | 预期现象和结论 |
分析:Ⅰ、(1)选择实验装置C,氧化锥形瓶中 气体压强变化分析现象和原因;
(2)根据二氧化碳的性质,即能和氢氧化钠反应,也能和溶液中的水反应,且溶解于水的性质回答;
(3)过量的氢氧化钠和二氧化碳反应生成的是碳酸钠,验证碳酸钠的存在利用氯化钙溶液进行验证;
Ⅱ、(4)①依据二氧化碳和氢氧化钠溶液反应过程分析判断,二氧化碳少量会得到氢氧化钠和碳酸钠混合溶液,恰好按照1:2反应生成碳酸钠,二氧化碳过量可以生成碳酸钠和碳酸氢钠混合物,二氧化碳足量生成碳酸氢钠;
②要验证NaHCO3和Na2CO3同时存在,根据题中所给试剂,要首先利用中性溶液BaCl2检验出碳酸钠,并将碳酸根离子全部沉淀,过滤后再滤液中加入盐酸生成气体分析判断含有碳酸氢钠;
(5)依据滴定实验计算混合物中碳酸钠物质的量,依据氢氧化钠溶液和二氧化碳反应生成的混合物中钠元素守恒计算得到碳酸氢钠物质的量,计算得到物质的量分数.
(2)根据二氧化碳的性质,即能和氢氧化钠反应,也能和溶液中的水反应,且溶解于水的性质回答;
(3)过量的氢氧化钠和二氧化碳反应生成的是碳酸钠,验证碳酸钠的存在利用氯化钙溶液进行验证;
Ⅱ、(4)①依据二氧化碳和氢氧化钠溶液反应过程分析判断,二氧化碳少量会得到氢氧化钠和碳酸钠混合溶液,恰好按照1:2反应生成碳酸钠,二氧化碳过量可以生成碳酸钠和碳酸氢钠混合物,二氧化碳足量生成碳酸氢钠;
②要验证NaHCO3和Na2CO3同时存在,根据题中所给试剂,要首先利用中性溶液BaCl2检验出碳酸钠,并将碳酸根离子全部沉淀,过滤后再滤液中加入盐酸生成气体分析判断含有碳酸氢钠;
(5)依据滴定实验计算混合物中碳酸钠物质的量,依据氢氧化钠溶液和二氧化碳反应生成的混合物中钠元素守恒计算得到碳酸氢钠物质的量,计算得到物质的量分数.
解答:解:Ⅰ、(1)选择实验装置C,探究CO2和NaOH确实发生了化学反应,胶头滴管中的氢氧化钠溶液挤入锥形瓶中发生反应CO2+2NaOH=Na2CO3+H2O,锥形瓶中气体压强减小,气球变大,
故答案为:气球变大,滴入的氢氧化钠溶液和二氧化碳反应,锥形瓶中气体压强减小,气球增大;
(2)二氧化碳通入氢氧化钠溶液时,二氧化碳也能溶解于水,且和水反应生成碳酸,也会出现类似上述现象,
故答案为:二氧化碳通入氢氧化钠溶液时,二氧化碳也能溶解于水,且和水反应生成碳酸,也会出现类似上述现象;
(3)实验D向锥形瓶中滴入过量的浓NaOH溶液后,滴加氯化钙溶液生成白色沉淀证明生成碳酸钠,
故答案为:氯化钙;
Ⅱ、(4)①碳和氢氧化钠溶液反应过程分析判断,二氧化碳少量会得到氢氧化钠和碳酸钠混合溶液,恰好按照1:2反应生成碳酸钠,二氧化碳过量可以生成碳酸钠和碳酸氢钠混合物,二氧化碳足量生成碳酸氢钠,
故答案为:NaOH和Na2CO3;
②要验证NaHCO3和Na2CO3同时存在,根据题中所给试剂,要首先利用中性溶液BaCl2检验出碳酸钠,并将碳酸根离子全部沉淀,过滤后再滤液中加入盐酸生成气体分析判断含有碳酸氢钠,
故答案为:取固体与试管中加水溶解,加入氯化钙溶液,过滤,向滤液中加入盐酸,出现白色沉淀,在过滤后的滤液中加入盐酸有气体生成证明含有碳酸氢钠;
(5)向100mL2mol/L的NaOH 溶液中通入一定量CO2,反应生成Na2CO3和NaHCO3,白色固体溶于水配得250ml溶液,取25.00mL 于锥形瓶中用酚酞作指示剂滴定至溶液由红色变无色时消耗0.2000moL?L-1HCl溶液25.00mL.反应反应Na2CO3+HCl=NaHCO3+NaCl依据消耗的盐酸物质的量为0.025L×0.2mol/L=0.005mol,则250ml溶液中含有0.5molNa2CO3物质的量为0.05mol,n(Na+)=0.1mol,依据钠元素守恒可知,钠元素共为0.1L×2mol/L=0.2mol,原混合物中含有NaHCO3物质的量为为0.1mol;碳酸氢钠物质的量分数=
×100%=66.7%,故答案为:66.7%.
故答案为:气球变大,滴入的氢氧化钠溶液和二氧化碳反应,锥形瓶中气体压强减小,气球增大;
(2)二氧化碳通入氢氧化钠溶液时,二氧化碳也能溶解于水,且和水反应生成碳酸,也会出现类似上述现象,
故答案为:二氧化碳通入氢氧化钠溶液时,二氧化碳也能溶解于水,且和水反应生成碳酸,也会出现类似上述现象;
(3)实验D向锥形瓶中滴入过量的浓NaOH溶液后,滴加氯化钙溶液生成白色沉淀证明生成碳酸钠,
故答案为:氯化钙;
Ⅱ、(4)①碳和氢氧化钠溶液反应过程分析判断,二氧化碳少量会得到氢氧化钠和碳酸钠混合溶液,恰好按照1:2反应生成碳酸钠,二氧化碳过量可以生成碳酸钠和碳酸氢钠混合物,二氧化碳足量生成碳酸氢钠,
故答案为:NaOH和Na2CO3;
②要验证NaHCO3和Na2CO3同时存在,根据题中所给试剂,要首先利用中性溶液BaCl2检验出碳酸钠,并将碳酸根离子全部沉淀,过滤后再滤液中加入盐酸生成气体分析判断含有碳酸氢钠,
故答案为:取固体与试管中加水溶解,加入氯化钙溶液,过滤,向滤液中加入盐酸,出现白色沉淀,在过滤后的滤液中加入盐酸有气体生成证明含有碳酸氢钠;
(5)向100mL2mol/L的NaOH 溶液中通入一定量CO2,反应生成Na2CO3和NaHCO3,白色固体溶于水配得250ml溶液,取25.00mL 于锥形瓶中用酚酞作指示剂滴定至溶液由红色变无色时消耗0.2000moL?L-1HCl溶液25.00mL.反应反应Na2CO3+HCl=NaHCO3+NaCl依据消耗的盐酸物质的量为0.025L×0.2mol/L=0.005mol,则250ml溶液中含有0.5molNa2CO3物质的量为0.05mol,n(Na+)=0.1mol,依据钠元素守恒可知,钠元素共为0.1L×2mol/L=0.2mol,原混合物中含有NaHCO3物质的量为为0.1mol;碳酸氢钠物质的量分数=
| 0.1mol |
| 0.1mol+0.05mol |
点评:本题考查了物质性质和成分的实验探究方法和实验设计应用,反应产物判断,元素守恒的计算应用是解题关键,题目难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目

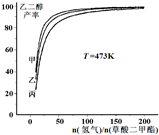 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
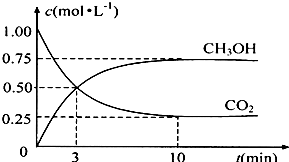
 法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)
法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
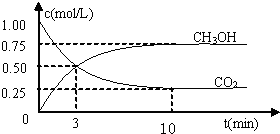 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注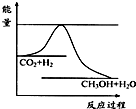 温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.