题目内容
6.某温度下,向2L恒容密闭容器中充入0.4mol NH3和0.3mol O2发生反应,5min后达到平衡,测得NH3的转化率为50%.①平衡时O2的转化率为83.3%.
②0~5min内O2的平均反应率v(O2)为0.025mol/(L•min).
③平衡时,H2O(g)的体积分数为40%.
分析 反应方程式为4NH3+5O2$?_{△}^{催化剂}$4NO+6H2O(g),5min后达到平衡,测得NH3的转化率为50%,可知转化氨气的物质的量为0.4mol×50%=0.2mol,则
4NH3+5O2$?_{△}^{催化剂}$4NO+6H2O(g),
起始(mol)0.4 0.3 0 0
转化(mol)0.2 0.25 0.2 0.3
平衡(mol)0.2 0.05 0.2 0.3
以此计算各物理量.
解答 解:反应方程式为4NH3+5O2$?_{△}^{催化剂}$4NO+6H2O(g),5min后达到平衡,测得NH3的转化率为50%,可知转化氨气的物质的量为0.4mol×50%=0.2mol,则
4NH3+5O2$?_{△}^{催化剂}$4NO+6H2O(g),
起始(mol)0.4 0.3 0 0
转化(mol)0.2 0.25 0.2 0.3
平衡(mol)0.2 0.05 0.2 0.3
(1)平衡时O2的转化率为$\frac{0.25}{0.3}×100%$=83.3%,故答案为:83.3%;
(2)0~5min内O2的平均反应率v(O2)为$\frac{\frac{0.25mol}{2L}}{5min}$=0.025mol/(L•min),故答案为:0.025mol/(L•min);
(3)平衡时,H2O(g)的体积分数为$\frac{0.3}{0.2+0.05+0.2+0.3}×100%$=40%,故答案为:40%.
点评 本题考查了化学平衡的计算,为高频考点,试题培养了学生的化学计算能力,题目难度不大,注意体会三段式发的运用.

T1温度时,向密闭容器中通入N2O5,部分实验数据见表:
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
②500s内N2O5分解速率为2.96×10-3mol•L-1•s-1;
③T1温度下 平衡时N2O5的转化率为50%.
 已知X、Y、Z、M、G是五种短周期主族元素,且原子序数依次增大.X原子核内只有1个质子,Y的原子最外层电子数是其电子层数的2倍,Y与G同主族,Z的一种单质能吸收对人体有害的紫外线,M是地壳中含量最高的金属元素.请回答下列问题:
已知X、Y、Z、M、G是五种短周期主族元素,且原子序数依次增大.X原子核内只有1个质子,Y的原子最外层电子数是其电子层数的2倍,Y与G同主族,Z的一种单质能吸收对人体有害的紫外线,M是地壳中含量最高的金属元素.请回答下列问题: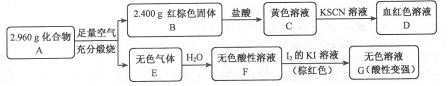
 .写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑.
.写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑.




 .
. .
. .
. .
. .
.