题目内容
【题目】(1)我国首创以铝_空气_海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为_____________;正极材料是__________,正极反应为_______________。
(2)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。阳极反应式:2CO+2CO![]() -4e-===4CO2,阴极反应式:____________,电池总反应式:____________ 。
-4e-===4CO2,阴极反应式:____________,电池总反应式:____________ 。
(3)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______________。若改用AlCl3水溶液作电解液,则阴极产物为_________。
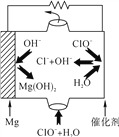
(4) “镁-次氯酸盐”燃料电池的装置如图所示,该电池的正极反应式为_________________。
【答案】 铝 4Al-12e-===4Al3+ 石墨等惰性电极 3O2+6H2O+12e-===12OH- O2+2CO2+4e-===2CO![]() 2CO+O2===2CO2 负 4Al2Cl7—+ 3e—= Al + 7AlCl4— H2 ClO-+2e-+H2O
2CO+O2===2CO2 负 4Al2Cl7—+ 3e—= Al + 7AlCl4— H2 ClO-+2e-+H2O![]() Cl-+2OH
Cl-+2OH
【解析】(1)该电池为原电池,负极材料为铝,铝失去电子,电极反应式为:4Al-12e-===4Al3+;正极材料为石墨等惰性电极,氧气在正极上得到电子发生还原反应,电极反应式为:3O2+6H2O+12e-===12OH-。
(2)空气中的O2在阴极得到电子并与CO2反应生成CO32-,阴极反应式为:. O2+2CO2+4e-===2CO32- ;将两个电极方程式相加得到电池总反应式:2CO+O2===2CO2。
(3) 钢制品上电镀铝,所以钢制品作阴极,连接电源的负极;Al2Cl7—在阴极上得到电子生成Al,从而铝镀在钢制品上,阴极电极反应式为4Al2Cl7—+ 3e—= Al + 7AlCl4—;若改用AlCl3水溶液作电解液,阴极上将是水溶液中的H+得到电子生成H2,故阴极产物为H2。
(4) “镁-次氯酸盐”燃料电池,镁作负极,ClO-在正极上得到电子生成Cl-,同时溶液中产生OH-,所以正极反应式为ClO-+2e-+H2O![]() Cl-+2OH。
Cl-+2OH。

 期末冲刺100分创新金卷完全试卷系列答案
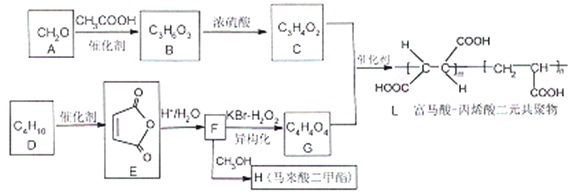
期末冲刺100分创新金卷完全试卷系列答案【题目】钻(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
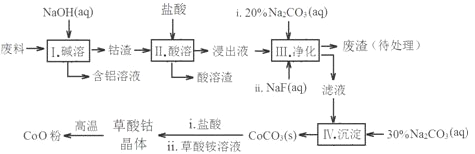
已知:LiF难溶于水,Li2CO3微溶于水。
请回答:
(1)写出I中发生反应的化学方程式并用单线桥标记电子转移的方向和数目________。
(2)写出步骤中Co2O3与盐酸反应生成Cl2的离子方程式_______________。
(3)步骤II所得废渣的主要成分除了LiF外,还有________________。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤IV所起的作用是___________。
(5)在空气中加热10.98g草酸钴晶体(CoC2O42H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。己知:M(CoC2O42H2O)=183g/mol。
温度范围/℃ | 固体质量/g |
150--210 | 8.82 |
290--320 | 4.82 |
890--920 | 4.5 |
经测定,加热到210℃时,固体物质的化学式为_____。加热到210--290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是_________。温度高于890℃时,固体产物发生分解反应,固体产物为__________。