题目内容
【题目】铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途. 请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如图1: 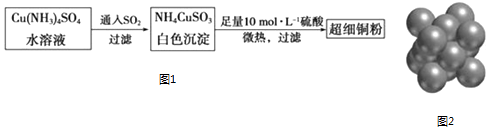
①Cu2+的价电子排布图; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为(填元素符号).
②SO42﹣的空间构型为 , SO32﹣离子中心原子的杂化方式为 .
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式.
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出SO4H2O晶体. ①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因.
(4)Cu晶体的堆积方式如图2所示,设Cu原子半径为r,晶体中Cu原子的配位数为,晶体的空间利用率为(列式).
【答案】
(1)![]() ;N>O>S;正四面体形;sp3杂化
;N>O>S;正四面体形;sp3杂化
(2)2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42﹣
(3)c;乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度
(4)![]() =
= ![]() ×100%=74.76%
×100%=74.76%
【解析】解:(1)①Cu2+的价层电子数是9个,所以Cu2+的价电子排布图为 ![]() ;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小,所以3种元素的第一电离能由大到小顺序为:N>O>S;所以答案是:
;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小,所以3种元素的第一电离能由大到小顺序为:N>O>S;所以答案是: ![]() ;N>O>S;②SO42﹣的价层电子对数=4+
;N>O>S;②SO42﹣的价层电子对数=4+ ![]() (6+2﹣4×2)=4,所以空间构型为正四面体型;SO32﹣离子的价层电子对数=3+
(6+2﹣4×2)=4,所以空间构型为正四面体型;SO32﹣离子的价层电子对数=3+ ![]() (6+2﹣3×2)=4,所以中心原子的杂化方式为sp3杂化;所以答案是:正四面体形;sp3杂化;(2)由流程图可知向Cu(NH3)4SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式,所以离子方程式为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42﹣;所以答案是:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42﹣;(3)①a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间,故a错误;b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角,故b 错误;c. Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键,故c正确;d. Cu(NH3)4SO4组成元素中电负性最大的是氧元素,故d错误,所以答案是:c;②根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;所以答案是:乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;(4)Cu晶体的堆积方式是面心立方最密堆积,所以配位数是12;由图可知,立方体的面的对角线长是4r,所以立方体的棱长a=2
(6+2﹣3×2)=4,所以中心原子的杂化方式为sp3杂化;所以答案是:正四面体形;sp3杂化;(2)由流程图可知向Cu(NH3)4SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式,所以离子方程式为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42﹣;所以答案是:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42﹣;(3)①a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间,故a错误;b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角,故b 错误;c. Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键,故c正确;d. Cu(NH3)4SO4组成元素中电负性最大的是氧元素,故d错误,所以答案是:c;②根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;所以答案是:乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;(4)Cu晶体的堆积方式是面心立方最密堆积,所以配位数是12;由图可知,立方体的面的对角线长是4r,所以立方体的棱长a=2 ![]() r,1个Cu的体积是
r,1个Cu的体积是 ![]() πr3 , 晶胞中Cu原子的个数是4个,所以晶体的空间利用率为
πr3 , 晶胞中Cu原子的个数是4个,所以晶体的空间利用率为 ![]() =
= ![]() ×100%=74.76%.所以答案是:12;
×100%=74.76%.所以答案是:12; ![]() =
= ![]() ×100%=74.76%.
×100%=74.76%.