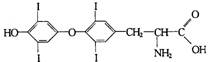
题目内容
工业上以海水为原料可获得金属镁及其多种化合物.其中Mg(OH)2是制备镁盐、耐火材料和阻燃剂等的重要原料.已知:①25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12;
②Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81.5kJ?mol-1.试回答下列问题:
(1)下列叙述正确的是______.(填字母序号)
A.从海水中获得Mg(OH)2工业上选择 NaOH作沉淀剂
B.Mg(OH)2能用作阻燃剂主要因为分解吸热且生成MgO覆盖可燃物
C.工业上由Mg(OH)2制金属镁的流程如下:

(2)已知酸碱指示剂百里酚蓝变色的pH范围如下:
25℃时,Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为______.
(3)达喜是中和胃酸的常用药物,其有效成分是铝和镁的碱式碳酸盐(可能带有结晶水).现进行如下实验确定化学式:
实验一:取该碱式盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g;
实验二:再取该碱式盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀.
①达喜中Mg2+与Al3+的物质的量之比为______.
②计算达喜的化学式,写出必要的计算过程.
②Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81.5kJ?mol-1.试回答下列问题:
(1)下列叙述正确的是______.(填字母序号)
A.从海水中获得Mg(OH)2工业上选择 NaOH作沉淀剂
B.Mg(OH)2能用作阻燃剂主要因为分解吸热且生成MgO覆盖可燃物
C.工业上由Mg(OH)2制金属镁的流程如下:

(2)已知酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
(3)达喜是中和胃酸的常用药物,其有效成分是铝和镁的碱式碳酸盐(可能带有结晶水).现进行如下实验确定化学式:
实验一:取该碱式盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g;
实验二:再取该碱式盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀.
①达喜中Mg2+与Al3+的物质的量之比为______.
②计算达喜的化学式,写出必要的计算过程.
(1)A、从海水中获得Mg(OH)2工业上选择 NaOH作沉淀剂,不符合生产的经济效益,故A不符合;
B、分解吸热且生成MgO难溶会覆盖可燃物,故B符合;
C、氯化镁溶液应在氯化氢气流中蒸发结晶,故C不符合;
故答案为:B;
(2)25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12;c(Mg2+)c2(OH-)=5.6×10-12;Mg(OH)2(s)?Mg2++2OH-;c(OH-)=2c(Mg2+)=x,得到0.5x×x2=5.6×10-12;
计算得到x=2.24×10-4mol/L;c(H+)=
=4.5×10-11mol/L,pH=10.4>9.6,所以溶液呈蓝色,
故答案为:蓝色;
(3)①实验一:取该碱式盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g;减少的是二氧化碳气体和水蒸气的质量;灼烧得到固体为氧化铝和氧化镁的混合物;
实验二:再取该碱式盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);可以计算碳元素物质的量;
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀.判断不是沉淀为氢氧化镁沉淀;
可得n(CO2)=n(CO32-)=
=0.005mol,
3.01g碱式碳酸盐中,含:n(Mg2+)=n[Mg(OH)2]=
=0.03mol
依据Al2O3和MgO质量为3.01g-1.30g=1.71g;依据元素守恒计算得到:n(Al3+)=2n(Al2O3)=2×(3.01-1.30-0.03×40)÷102=0.01mol;
得到n(Mg2+):n(Al3+)=0.03mol:0.01mol=3:1,
故答案为:3:1;
②3.01g碱式碳酸盐中,含:n(Mg2+)=n[Mg(OH)2]=
=0.03mol,依据Al2O3和MgO质量为3.01g-1.30g=1.71g,依据元素守恒计算得到
n(Al3+)=2n(Al2O3)=
=0.01mol,
n(CO32-)=n(CO2)=0.005mol,
n(OH-)=(0.03×2+0.03×3-0.005×2)=0.08mol,
n(H2O)=
=0.02mol,
所以n(Al3+):n(Mg2+):n(OH-):n(CO32-):n(H2O)=0.01mol:0.03mol:0.08mol:0.005mol:0.02mol=2:6:16:1:4,
即碱式碳酸盐的化学式为:Al2Mg6(OH)16CO3?4H2O,
答:达喜的化学式为Al2Mg6(OH)16CO3?4H2O.
B、分解吸热且生成MgO难溶会覆盖可燃物,故B符合;
C、氯化镁溶液应在氯化氢气流中蒸发结晶,故C不符合;
故答案为:B;
(2)25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12;c(Mg2+)c2(OH-)=5.6×10-12;Mg(OH)2(s)?Mg2++2OH-;c(OH-)=2c(Mg2+)=x,得到0.5x×x2=5.6×10-12;
计算得到x=2.24×10-4mol/L;c(H+)=
| 10-14 |
| 2.24×10-4 |
故答案为:蓝色;
(3)①实验一:取该碱式盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g;减少的是二氧化碳气体和水蒸气的质量;灼烧得到固体为氧化铝和氧化镁的混合物;
实验二:再取该碱式盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);可以计算碳元素物质的量;
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀.判断不是沉淀为氢氧化镁沉淀;
可得n(CO2)=n(CO32-)=
| 0.112L |
| 22.4L/mol |
3.01g碱式碳酸盐中,含:n(Mg2+)=n[Mg(OH)2]=
| 1.74g |
| 58g/mol |
依据Al2O3和MgO质量为3.01g-1.30g=1.71g;依据元素守恒计算得到:n(Al3+)=2n(Al2O3)=2×(3.01-1.30-0.03×40)÷102=0.01mol;
得到n(Mg2+):n(Al3+)=0.03mol:0.01mol=3:1,
故答案为:3:1;
②3.01g碱式碳酸盐中,含:n(Mg2+)=n[Mg(OH)2]=
| 1.74g |
| 58g/mol |
n(Al3+)=2n(Al2O3)=
| 2×(3.01-1.30-0.03×40) |
| 102 |
n(CO32-)=n(CO2)=0.005mol,
n(OH-)=(0.03×2+0.03×3-0.005×2)=0.08mol,
n(H2O)=
| (1.30-0.04×18-0.005×44) |
| 18 |
所以n(Al3+):n(Mg2+):n(OH-):n(CO32-):n(H2O)=0.01mol:0.03mol:0.08mol:0.005mol:0.02mol=2:6:16:1:4,
即碱式碳酸盐的化学式为:Al2Mg6(OH)16CO3?4H2O,
答:达喜的化学式为Al2Mg6(OH)16CO3?4H2O.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
工业上以海水为原料可获得金属镁及其多种化合物.其中Mg(OH)2是制备镁盐、耐火材料和阻燃剂等的重要原料.已知:①25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12;
②Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81.5kJ?mol-1.试回答下列问题:
(1)下列叙述正确的是______.(填字母序号)
A.从海水中获得Mg(OH)2工业上选择 NaOH作沉淀剂
B.Mg(OH)2能用作阻燃剂主要因为分解吸热且生成MgO覆盖可燃物
C.工业上由Mg(OH)2制金属镁的流程如下:

(2)已知酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
(3)达喜是中和胃酸的常用药物,其有效成分是铝和镁的碱式碳酸盐(可能带有结晶水).现进行如下实验确定化学式:
实验一:取该碱式盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g;
实验二:再取该碱式盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀.
①达喜中Mg2+与Al3+的物质的量之比为______.
②计算达喜的化学式,写出必要的计算过程.
工业上以海水为原料可获得金属镁及其多种化合物.其中Mg(OH)2是制备镁盐、耐火材料和阻燃剂等的重要原料.已知:①25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12;
②Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81.5kJ?mol-1.试回答下列问题:
(1)下列叙述正确的是______.(填字母序号)
A.从海水中获得Mg(OH)2工业上选择 NaOH作沉淀剂
B.Mg(OH)2能用作阻燃剂主要因为分解吸热且生成MgO覆盖可燃物
C.工业上由Mg(OH)2制金属镁的流程如下:

(2)已知酸碱指示剂百里酚蓝变色的pH范围如下:
25℃时,Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为______.
(3)达喜是中和胃酸的常用药物,其有效成分是铝和镁的碱式碳酸盐(可能带有结晶水).现进行如下实验确定化学式:
实验一:取该碱式盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g;
实验二:再取该碱式盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀.
①达喜中Mg2+与Al3+的物质的量之比为______.
②计算达喜的化学式,写出必要的计算过程.
②Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81.5kJ?mol-1.试回答下列问题:
(1)下列叙述正确的是______.(填字母序号)
A.从海水中获得Mg(OH)2工业上选择 NaOH作沉淀剂
B.Mg(OH)2能用作阻燃剂主要因为分解吸热且生成MgO覆盖可燃物
C.工业上由Mg(OH)2制金属镁的流程如下:

(2)已知酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
(3)达喜是中和胃酸的常用药物,其有效成分是铝和镁的碱式碳酸盐(可能带有结晶水).现进行如下实验确定化学式:
实验一:取该碱式盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g;
实验二:再取该碱式盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀.
①达喜中Mg2+与Al3+的物质的量之比为______.
②计算达喜的化学式,写出必要的计算过程.