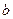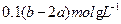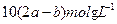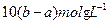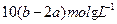题目内容
(6分)某溶液中仅含有Na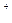 、Mg
、Mg 、SO
、SO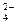 、Cl
、Cl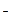 四种离子,其中Na
四种离子,其中Na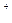 ∶Mg
∶Mg ∶Cl-=4∶5∶8,若设Na
∶Cl-=4∶5∶8,若设Na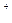 为4n个,则SO
为4n个,则SO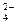 的个数为;该溶液可能由(多选)溶于水混合而得到。
的个数为;该溶液可能由(多选)溶于水混合而得到。
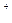 、Mg
、Mg 、SO
、SO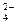 、Cl
、Cl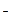 四种离子,其中Na
四种离子,其中Na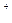 ∶Mg
∶Mg ∶Cl-=4∶5∶8,若设Na
∶Cl-=4∶5∶8,若设Na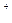 为4n个,则SO
为4n个,则SO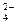 的个数为;该溶液可能由(多选)溶于水混合而得到。
的个数为;该溶液可能由(多选)溶于水混合而得到。A.NaCl、MgCl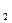 、MgSO 、MgSO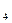 | B.Na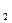 SO SO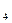 、MgSO 、MgSO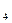 、MgCl 、MgCl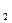 |
C.Na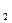 SO SO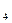 、NaCl、MgCl 、NaCl、MgCl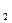 | D.NaCl、MgSO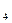 |
3n AB
任何电解质溶液总是电中性的。这是因为溶液里虽然有阴、阳离子,但全部阳离子所带正电荷的总量一定等于全部阴离子所带负电荷的总量,这就是电荷守恒规律。根据题意,设Na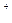 为4n个,则Mg
为4n个,则Mg 为5n个,Cl
为5n个,Cl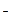 为8n个,现设SO
为8n个,现设SO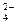 为x个,则有4n+5n×2=8n+2x,解得x=3n。同理,在所给的A、B、C、D四个选项中,只有A、B选项可能满足上述条件,C、D选项不符合上述离子的比例关系。
为x个,则有4n+5n×2=8n+2x,解得x=3n。同理,在所给的A、B、C、D四个选项中,只有A、B选项可能满足上述条件,C、D选项不符合上述离子的比例关系。
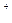 为4n个,则Mg
为4n个,则Mg 为5n个,Cl
为5n个,Cl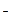 为8n个,现设SO
为8n个,现设SO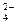 为x个,则有4n+5n×2=8n+2x,解得x=3n。同理,在所给的A、B、C、D四个选项中,只有A、B选项可能满足上述条件,C、D选项不符合上述离子的比例关系。
为x个,则有4n+5n×2=8n+2x,解得x=3n。同理,在所给的A、B、C、D四个选项中,只有A、B选项可能满足上述条件,C、D选项不符合上述离子的比例关系。
练习册系列答案
相关题目
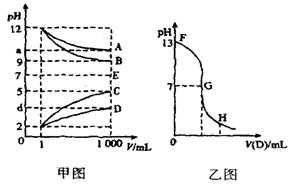
 反应时所消耗B、C溶液的体积比VB:VC=
反应时所消耗B、C溶液的体积比VB:VC=  有
有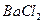 和
和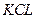 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含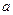
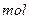 硫酸钠
硫酸钠