题目内容
(10分)有A、B、C、D四种离子化合物,组成它们的离子分别为:
阳离子:Na+、Al3+、NH4+; 阴离子:OH-、NO3-、CO32-、HSO4-
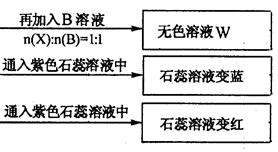
为鉴别四种化合物,某学生分别取少量固体配成溶液,编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已略去)
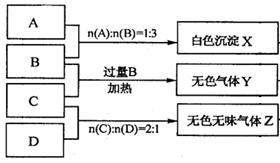
(1) Y、Z的化学式分别为:Y ;Z
(2)写出指定反应的离子方程式:
①加热条件下,C与过量B反应:
②D溶液显弱碱性的原因是(用离子方程式表示)
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是(用化学式表示)
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中离子浓度从大到小的顺序是:
阳离子:Na+、Al3+、NH4+; 阴离子:OH-、NO3-、CO32-、HSO4-
为鉴别四种化合物,某学生分别取少量固体配成溶液,编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已略去)


(1) Y、Z的化学式分别为:Y ;Z
(2)写出指定反应的离子方程式:
①加热条件下,C与过量B反应:
②D溶液显弱碱性的原因是(用离子方程式表示)
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是(用化学式表示)
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中离子浓度从大到小的顺序是:
(1)NH3(1分) CO2(1分)
(2)①NH4++H++2OH-=NH3↑+2H2O(2分) ②CO32-+H2O HCO3-+OH- (2分)
HCO3-+OH- (2分)
(3) NaOH>Na2CO3>Al(NO3)3>NH4HSO4(2分)
(4) c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)(2分)
(2)①NH4++H++2OH-=NH3↑+2H2O(2分) ②CO32-+H2O
 HCO3-+OH- (2分)
HCO3-+OH- (2分)(3) NaOH>Na2CO3>Al(NO3)3>NH4HSO4(2分)
(4) c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)(2分)
(1)能使紫色的石蕊试液显蓝色的是氨气,能使紫色石蕊试液显红色的是酸性气体,所以根据题意可知Y是氨气,Z是CO2。
(2)白色沉淀X能溶于B中,因此沉淀氢氧化铝,所以根据反应的物质的量之比可知,A是硝酸铝,B是氢氧化钠。C是硫酸氢铵,D是碳酸钠。
①加热条件下,C与过量B反应的方程式为NH4++H++2OH-=NH3↑+2H2O。
②碳酸钠是强碱弱酸盐,CO32-水解显碱性,方程式为CO32-+H2O HCO3-+OH-。
HCO3-+OH-。
(3)氢氧化钠是强碱,碱性最强。碳酸钠水解显碱性,硝酸铝水解显酸性,硫酸氢铵电离出氢离子显酸性,所以等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是NaOH>Na2CO3>Al(NO3)3>NH4HSO4。
(4)B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中含有的溶质是硫酸钠、硫酸铵和氨水,所以溶液中离子浓度从大到小的顺序是 c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)。
(2)白色沉淀X能溶于B中,因此沉淀氢氧化铝,所以根据反应的物质的量之比可知,A是硝酸铝,B是氢氧化钠。C是硫酸氢铵,D是碳酸钠。
①加热条件下,C与过量B反应的方程式为NH4++H++2OH-=NH3↑+2H2O。
②碳酸钠是强碱弱酸盐,CO32-水解显碱性,方程式为CO32-+H2O
 HCO3-+OH-。
HCO3-+OH-。(3)氢氧化钠是强碱,碱性最强。碳酸钠水解显碱性,硝酸铝水解显酸性,硫酸氢铵电离出氢离子显酸性,所以等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是NaOH>Na2CO3>Al(NO3)3>NH4HSO4。
(4)B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中含有的溶质是硫酸钠、硫酸铵和氨水,所以溶液中离子浓度从大到小的顺序是 c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)。

练习册系列答案
 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
 ,
,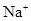 ,
,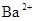 ,
,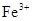 ,
, ,
,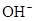 ,
,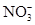 ,
,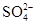 中各不相同的四种离子,若单独排放仍会造成环境污染,如果两厂的污水按适当比例混合,经沉淀后污水变成硝酸钠溶液,下列判断正确的是( )
中各不相同的四种离子,若单独排放仍会造成环境污染,如果两厂的污水按适当比例混合,经沉淀后污水变成硝酸钠溶液,下列判断正确的是( )