题目内容
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用ClO2氧化氮氧化物反应过程如下:
NO NO2
NO2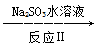 无污染物
无污染物
反应Ⅰ的化学方程式是2NO+ClO2+H2O=NO2+HNO3+HCl,反应Ⅱ的化学方程式是__________________________。
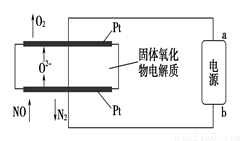
(2)利用固体氧化物电解池通过电解方式分解氮氧化物的过程如图3所示,写出电解池中通入NO一端的电极反应式:_______________________。
(3)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
①则NO2 与SO2反应的热化学方程式为______________________。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_____________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
e.混合气体的平均分子量不再变化
③测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡时NO2的转化率=____________。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



 法正确的是
法正确的是
 O2(g)=CO2(g)+2H2(g)△H=-akJ/mol,则a ________238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g)△H=-akJ/mol,则a ________238.6(填“>”、“<”或“=”)。