题目内容
下表为某汽车在不同速率时所产生的空气污染物质量(按汽车平均行驶1公里计算)
根据上表,下列说法不正确的是
A.汽车行驶时,污染物中CO含量最高
B.汽车速率为120 km·h一1时,污染最严重
C.从环保角度考虑,最合适的汽车速率为50 km·h-1
D.汽车速率增大时,产生的氮的氧化物也随之增多
| 污染物/g·km―1 | 速率/km·h-1 | ||
| 50 | 80 | 120 | |
| 一氧化碳 氮的氧化物 碳氢化合物 | 8.7 0.6 0.7 | 5.4 1.5 0.6 | 9.6 3.8 0.8 |
A.汽车行驶时,污染物中CO含量最高
B.汽车速率为120 km·h一1时,污染最严重
C.从环保角度考虑,最合适的汽车速率为50 km·h-1
D.汽车速率增大时,产生的氮的氧化物也随之增多
C
根据表中数据可知,速率为50 km·h-1时,污染物并不是最低的,因此从环保角度考虑,最合适的汽车速率为50 km·h-1,所以选项C是错误的,答案选C.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
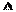 n(H+)= mol。
n(H+)= mol。 N2O4(g) △H<0的平衡常数K=13.3。
N2O4(g) △H<0的平衡常数K=13.3。 CH3OH(g),己知该反应在300OC时的化学平衡常数为0.27,该温度下将2moI CO、3mol H2利2molCH3OH(g)充入容积为2 L的密闭容器中,此时反应将 。(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
CH3OH(g),己知该反应在300OC时的化学平衡常数为0.27,该温度下将2moI CO、3mol H2利2molCH3OH(g)充入容积为2 L的密闭容器中,此时反应将 。(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。