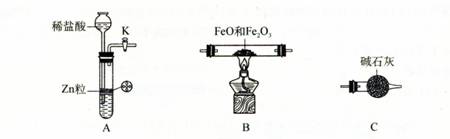
题目内容
为测定 FeO 和 Fe2O3 固体混合物中 Fe元素的含量,可用氢气还原一定质量的此混合物并测定生成水的质量的方法来完成。若在实验室中选用下列实验装置来实现上述目的(图中夹持装置已略去,部分装置可重复使用)。请填空:

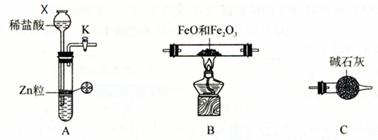
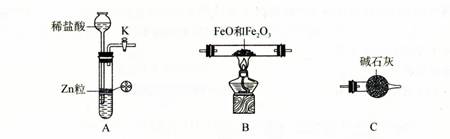
⑴仪器X的名称是 。
⑵写出A中发生反应的离子方程式 ,
实验前如何检验装置A的气密性 。
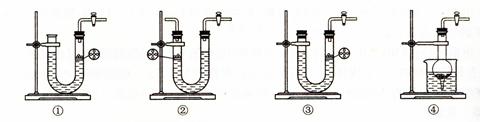
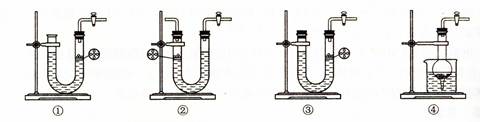
⑶下图所示装置中与A装置具有相同作用的是 (填装置编号)。

⑷按正确的实验设计,所连接的装置顺序为:A→C→ → → 。
⑸若FeO和Fe2O3混合物的质量为 ag,反应完全后生成水的质量为 b g,则混合物中Fe元素的质量分数为 (用含字母的数学式表示)。
(12分)⑴长颈漏斗。⑵Zn +2H+ = Zn2+ + H2↑,
关闭活塞K,向长颈漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气。
⑶①④ ⑷B→C→C。 ⑸(1-8b/9a)×100%(或1-8b/9a)(其他合理答案也可。)
【解析】(1)根据X的结构可知,X是长颈漏斗。
(2)A装置是制取氢气的,所以方程式为Zn +2H+ = Zn2+ + H2↑。由于A装置中是长颈漏斗,所以检验气密性的正确方法是关闭活塞K,向长颈漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气。
(3)A装置是简易启普发生器,当关闭K后,产生的气体使固体和液体分离,从而反应停止。所以选项①④正确。
(4)由于生成的氢气中会混有氯化氢和水蒸气,所以应该先除杂和干燥。由于要测量反应中生成的水蒸气,且还要防止空气中的水蒸气进入,因此正确的连接顺序是A→C→B→C→C。
(5)bg水中氧元素的质量是8b/9,所以混合物中铁元素的质量是(a-8b/9)g,因此铁元素的质量分数是(1-8b/9a)×100%(或1-8b/9a)。